Bonjour,
J'ai quelques problèmes a amplifier un malheureux gène depuis un certains temps et ca commence a devenir long,
la plante en question est connue pour être récalcitrante aux extractions ADN-ARN suivi de PCR (litterature), mais mon responsable m'assure que son kit donne de bon résultats,
En effet après controle qualité au Nanodrop j'obtiens des courbes potables, des concentration environnant les 60-90 ng/microlitre avec des ratio proches de 2 (sauf pour le ration 260/230 pour l'ADN ou j'obtiens quelque chose proche de 0.8
Cependant je n'arrive toujours pas a choper ce gène, et le problème peut venir de plusieurs endroits, mais je peux pas les tester
En l’occurrence j'utilise des primers dégénérés, mais la dégénérescence des séquences est assez limités (les aa trop dégénérés sont évités) et il s'agit de séquences conservés chez les plantes de la même famille, donc le problème ne devrait pas venir des primers
Je me demandais si un résultat Nanodrop pouvait être plutot bon, et avoir quand même un échantillon pollué, vu que le ratio 260/280 est pour vrifier la purification protéique, et le 260/230 je ne sais pas, donc peut être qu'il y a autre chose qui est resté mais pas mesuré par nanodrop, et empêche l'action de la Taq (plante riche en polyphénols et polysaccharides)
J'utilise la Taq de invotrogen, mais dans leur protocol ils prennent un volume total de 100 microlitres, cependant pour le template ils disent juste 1-20 microlitres, (ce qui en soi est une fourchette assez élevée) et ne donnent pas d'indication sur la quantité d'ADN en ng optimale a prendre,
Pour ma part j'ai tout divisé par 4 pour avoir un volume total de 25 microlitres, peut etre que le volume est trop faible je ne sais pas, mais tant que tout reste proportionnel ca devrait etre bon je pense,
J'utilise 1 microlitre (80ng/microlitre) de template ADN du coup comme ils précisent pas grand chose d'autre peut être que c'est trop pour un volume total de 25, mais comme pour 100 ils disent jusqu’à 20 .... sans préciser de concentration.
pour la Taq elle même, ils conseillent 0.2-0.5 microlitre pour 100, j'utilise 0.1 pour 25
pour le reste j'utilise 30 cycles aux températures indiquées dans le protocole, sauf pour le Ta, ils disent 55, j'utilise 57°C pour un Tm moyen des primers dégénéré de 58°C
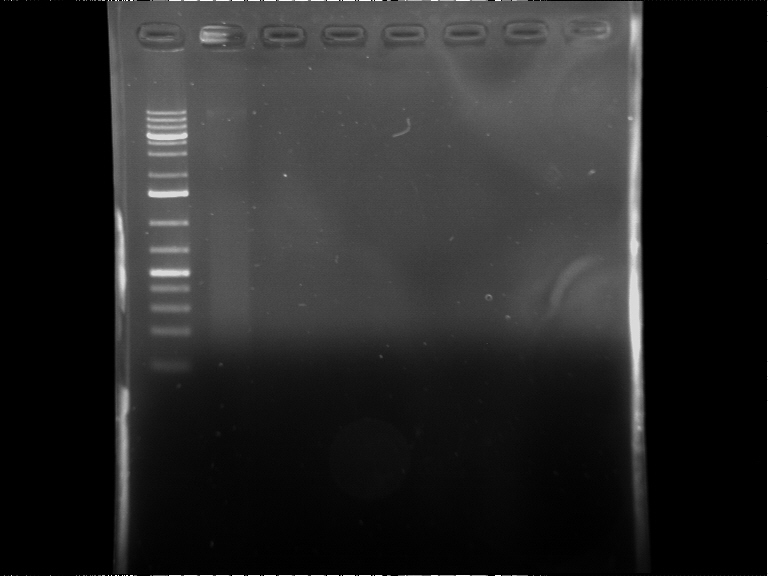
la taille attendue est de 300 bases, et pourtant j'obtiens des gels vides,
Utiliser un protocole spé semble exclu par mon responsable,
j'ai réussi a le convaincre d'acheter des primers contrôles, mais il ne les commandera pas avant lundi, ce qui veut dire que je les aurai sûrement mercredi, et dans le doute ou le problème viendrait pas de mes primers dégénérés et que les primers contrôles n'amplifient rien non plus, je vois pas comment distinguer si c'est l'extraction qu'a foiré (malgré que les résultats nanodrop soient corrects) ou si le problème vient du protocole PCR
Merci a qui pourra m m'aider (et a tout ceux qui tenterons bien entendu)
-----