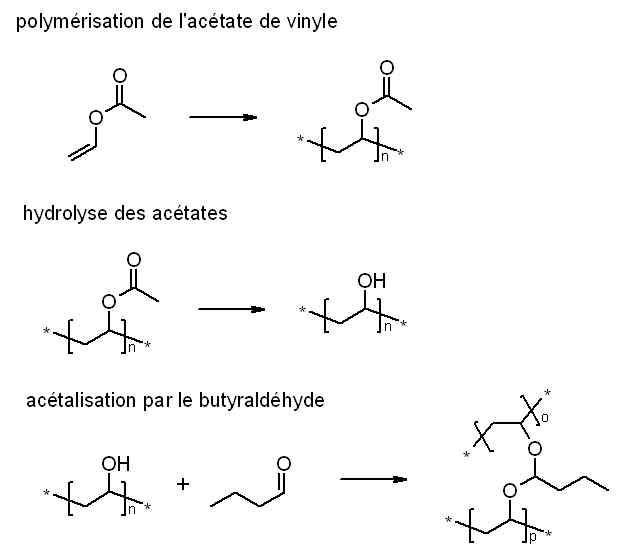
Le PVB (PolyVinylButyral pour les intimes ) est un polymère utilisé dans la fabrication du verre feuilleté, notement pour les pares brise des voitures.
La création de PVB requiert de l'acétate de vinyle qui par polymérisation radicalaire deviens de l'acétate de polyvinyle (PVAc). Ce PVAc est hydrolysé en alcool polyvinylique (PVOH) en présence d'un catalyseur acide. Le PVOH est ensuite mis en réaction avec du butyraldéhyde (ButAL) en présence d'acide. Ceci mène à la création de PVB.
Il est à noter que la transformation du PVAc en PVOH est une réaction équilibrée et donc incomplète. En outre elle peut être considérée comme athermique. En effet lorsque l'ont fait la somme des énergies de liaison avant et après l'on s'aperçoit que la réaction ne libère ni ne capture de l'énergie thermique.
Pour avoir une adhésion optimale au verre, il est très important de disposer d'un maximum de groupes alcool ( -OH) sur la chaine. Pour ce faire il faut favoriser la réaction directe, soit en enlevant l'acétate au fur et a mesure qu'il est produit soit en mettant du produit en excès.
La question que je me pose est "pourquoi le PVB ne peut être synthétisé directement?".
En outre je me demandait également a partir que quoi fabriquaient - ils le PVB. Quel sont les matériaux de bases desquelle ils synthétisent l'acétate de vinyle?
D'or et déjà un grand merci pour toutes vos réponses.
-----






 )est plus précisément:
)est plus précisément: