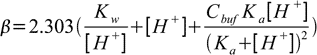Bonsoir.
J'ai trouvé cet exercice dans un de mes livres.
Dans un litre d’eau sont présents :
1.10-2 mol d’acide nitrique
2.10-2 mol d’hydroxyde de potassium
1.10-2 mol d’acétate de sodium
3.10-2 mol d’acide acétique
a) Calculer le pH de la solution (on s’aidera d’un ou plusieurs diagramme(s) du γ)
b) Calculer son pouvoir tampon.
c) La solution est diluée 10 fois. Que valent pH et pouvoir tampon ?
J'aimerai avoir des pistes pour réussir cet exercice. Comment on sait si les espèces sont des acides forts ou des acides faibles, par exemple ?
-----