Bonjour,
Ce que j'ai toujours su ou compris depuis longtemps c'est que un mélange azéotrope est un mélange de deux composés qui ont ensemble un point d'ébullition propre qui peut être en dessous ou en dessus des points des deux composés distincts (on parle d'azéotropisme positif si les pE des autres sont au dessus et négatif si ils sont au-dessous) (moyen memotechnique je me dis qu'on appelle "positif" car en pratique si le mélange bout à un température plus basse c'est quelque chose de... positif si par exemple on veut le distiller !)
Je sais aussi qu'on ne peut pas prédire un mélange azéotropique et que la science ne sait pas encore vraiment ce qu'il se passe au niveau des liaisons intermoléculaires.
Maintenant il y a quelques trucs que je ne comprends plus :
1) Comment diable pourrait-on distiller (par distillation fractionnée) un mélange azéotropique pour séparer si les deux ont le même point d'ébullition ?
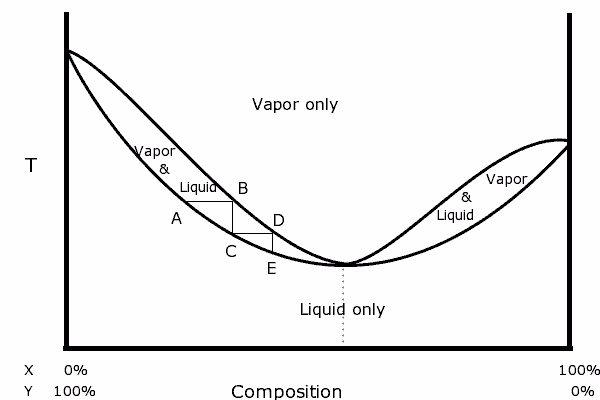
2) Qu'est qu'un diagramme binaire ?
(https://upload.wikimedia.org/wikiped...aseDiagram.png)
En est-ce un ? Je n'arrive pas à l'interpréter j'y vois que en fonction du rapport entre les deux composés le point d'ébullition change ? Si ce n'est pas ça, y a-t-il un moyen pour connaître le point d'ébullition en fonction du rapport ? J'imagine que 50/50 d'alcool/eau s'évapore à une autre température que 60/40.
-----