Bonjours,
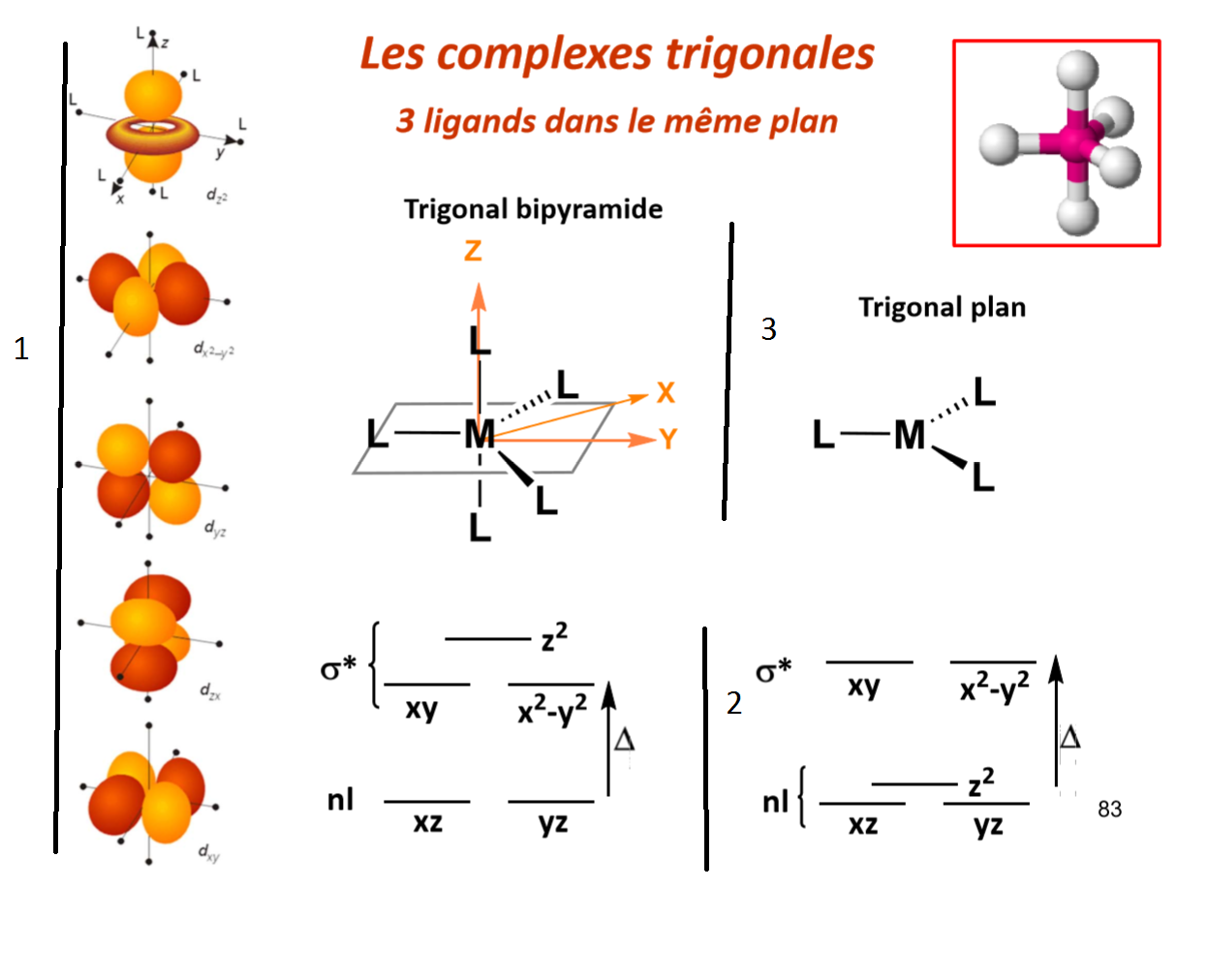
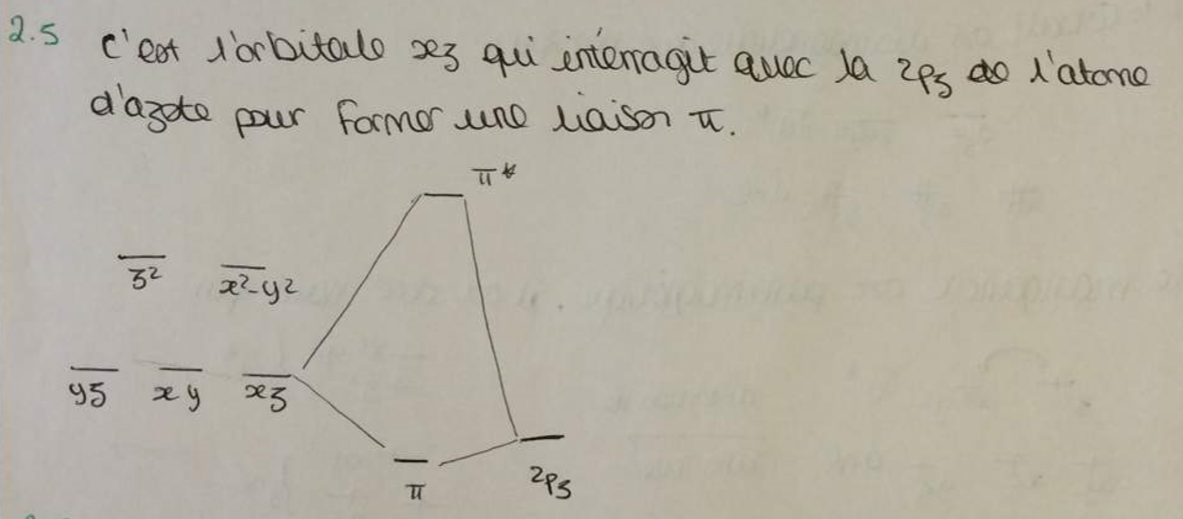
Voici un exercice sur lequel je bloque. En effet, il s'agit du complexe vanadium, il faut répondre à la question 2-5 quel orbitale d interagit fortement avec l'orbitale 2pz de l'atome d'azote ? je ne sais pas comment le résoudre et j'ai la correction quelqu'un pourrait me donner des pistes pour résoudre les deux dernières question ?
Comment savoir en générale quel orbitale interagit avec quel orbitale ?
La réponse à la question 2-4 est x=2, je ne comprend pas le sens même de la question
PS : Je comprend parfaitement le début de l'exercice jusqu'à la question 2-4.
Merci d'avance pour vos réponse !
Cordialement,
-----