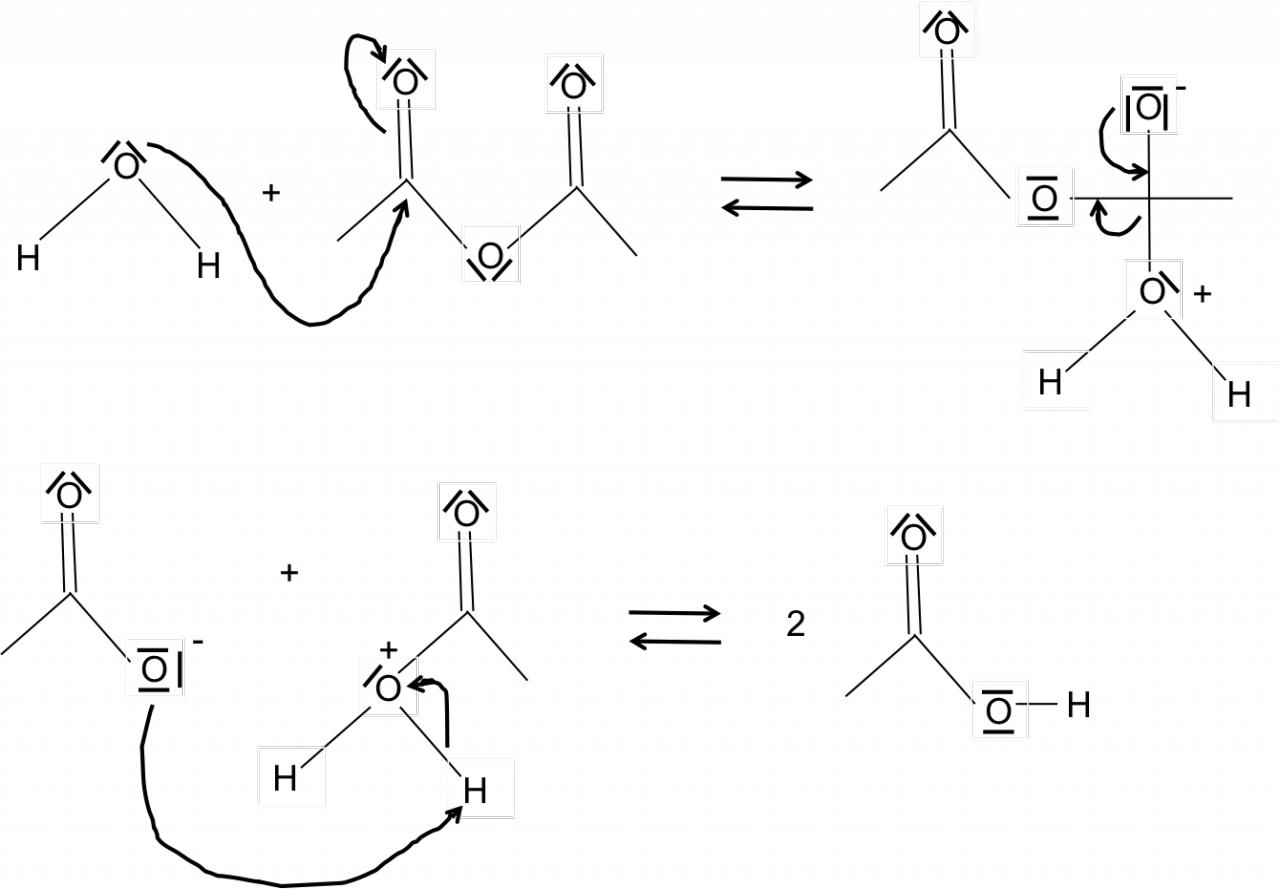
Bonjour,
Je connais l'hydrolyse de l'anhydride acétique qui donne donc de l'acide acétique :
(CH3CO)2 + H2O -> 2 CH3COOH
mais je ne vois vraiment pas comment écrire le mécanisme réactionnel (avec les flèches courbes) qui donne ce résultat. Je sais que ce ne serait pas vraiment simple à indiquer sans dessin mais je suis vraiment perdue là. Je sais que les flèches courbes sont orientées d'un site donneur (un nucléophile) de doublet d'électrons vers un site accepteur (un électrophile). J'aurais envie de faire partir une flèche de l'atome O de l'eau vers un carbone de l'anhydride acétique où y'a une double liaison (et une flèche de la double liaison sur l'atome O concerné) mais ça fait plutôt une réaction d'addition, non ?
-----