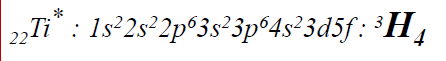Salut,
On a ces deux configurations:
(Ti, Z = 22) 1s² 2s² 2p6 3s² 3p6 3d² 4s²
(Co, Z = 27): [Ar] 3d7 4s2
Es-ce-que quelqu'un peut me dire pourquoi dans la deuxième configuration L=F=3 et J=7/2 (L'état qui correspond à la plus basse énergie)
** Une deuxième question: Es-ce-qu'il faut toujours prendre J=L+S pair? si oui, pour quel raison?
(Le résultat est connu, je veut seulement des explication)
Merci
-----