Bonjour,
Dans le cadre de mon TIPE (qui consiste à créer un système de cryptage seulement à partir de porte logique électronique, sans aucune programmation), je dois comprendre comment fonctionne les transistors bipolaires.
J'essaie donc de comprendre dans un premier temps la notion de semi-conducteurs et plus particulièrement la théorie des bandes.
J'ai repris un vieux cours de mon professeur de physique mais il y a quelque chose que je ne comprends pas.
Je précise que j'ai fais l'impasse sur certaines notions (Fonction d'onde, diagramme d'orbital moléculaire sur une couche d'ordre 2 ou plus).
Par contre, je connais la notion d'orbital atomique.
Voila ce que je ne comprends pas:
Je sais pas si vous allez réussir à voir l'image, dans le doute je met le lien: les images doivent êtres postées en tant que pièces jointes http://forums.futura-sciences.com/ph...s-jointes.html
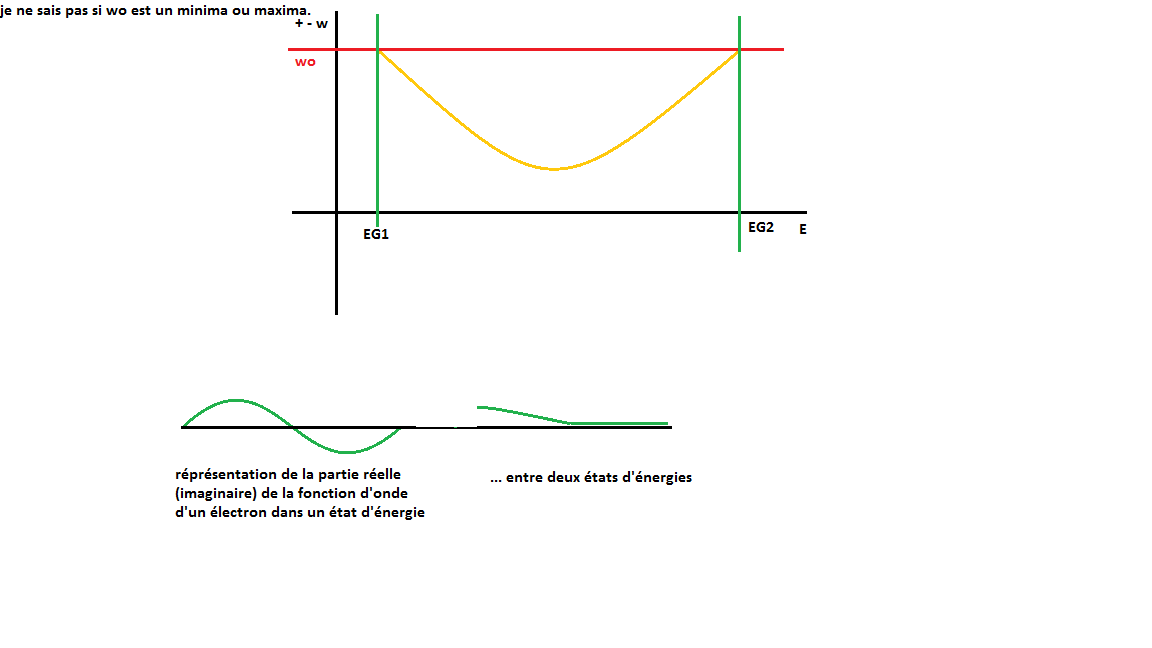
J'essaie en quelques sortes de comprendre le schéma dessine par mon prof du cristal de Na à partir du diagramme des orbitales moléculaires du dihydrogène.
J'aimerai savoir si les éléments entourés en couleurs correspondent "aux mêmes choses".
C'est-à-dire
1/si la bande encadrée en bleu correspond aux orbites liants et à la bande de valence.
2/si celle en verte correspond aux OM anti-liants et à la bande de conduction
(j'imagine que vu que les electrons ne se lient pas, ils peuvent se "balader" dans le cristal et donc sont libres).
3/ J'ai vu sur des sites qu'il existait une bande de cœur (électrons proche du noyau) et sur d'autres sites que les électrons proches du noyau n'interagissait pas avec les autres atomes donc il n'y a pas de bande de cœur, je ne sais pas qui croire, ou si j'ai bien compris.
4/Si j'ai bien compris 1/ et 2/, la température peut briser des liaisons covalentes, mais à partir de ce fait, je commence à tout confondre.
Lorsque l'on écrit par exemple: O: (1s 2s) 2p4 cette notation peut changer dans le cas ou l'atome d'oxygène reçoit une énergie correspondant à deltaE=hv.
Merci d'avance !
-----