jai un exercice à resoudre
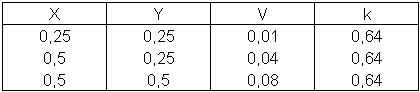
x mol/l y mol/l vitesse de reaction (mol/l s)
1 0,25 0,25 0,01
2 0,50 0,25 0,04
3 0,50 0,50 0,08
l'ordre par rapport à X c'est 2
à Y c'est 1
est ce que c'est bien juste???
V= k [X]2 [Y]
k = V/ [X]2 [Y] = 0,01 mol/l s / ( 0,25 mol/l)2 0,25 mol/l = 0,64 mol -2 l 2 s -1
les grands 2 et 1 ce sont des exposants.
est ce que jai bien calcule
la constante cinétique et les unites sont aussi juste???
jattends vos reponses )))
-----