Bonjour!
J'essaye de traiter la question suivante:
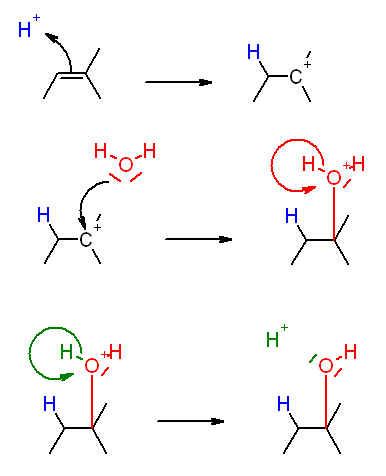
Sachant que l'hydratation du 2-méthylbut-2-ène donne deux composés dont majoritairement le composé A de formule brute C5H12O, donner la formule semi développée de A et le nommer.
Voici en pièce jointe ma réponse, qu'en pensez vous?
-----