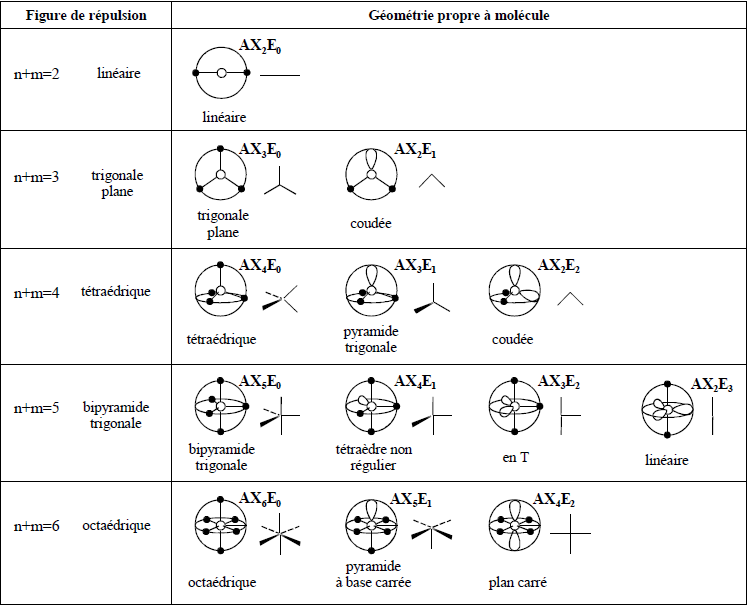
Bonjour,
Dans mon cours, il est écrit qu'à partir de ce "concept" AXmEn nous pouvions déduire la géométrie de la molécule. Sachant que A est l'atome central, X représente le nombre d'atome qui sont liés à A et E Le nombre de paires électroniques libres (PEL) de l'atome central A.
Ce que je n'arrive pas à saisir, c'est comment peut-on savoir combien y'a t-il de PEL lié à l'atome central A sans dessinez la molécule, et donc sur simple coup d'oeil.
Je ne sais pas si j'ai été clair...
-----