Bonjour,
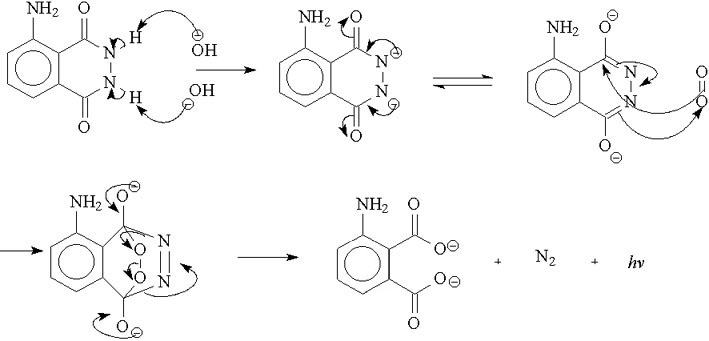
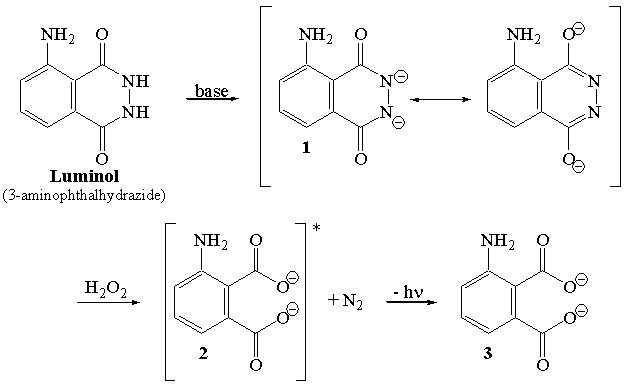
Actuellement en deuxième année de prépa PC je réalise un TIPE sur le luminol. Lors de la réaction, on fait intervenir H2O2 qui est dismuté par des ions hexacyanoferrate afin d'obtenir O2 qui oxydera le luminol, créant la réaction de luminescence. Cependant je ne vois pas à quoi cela peut servir étant donné que l'air contient déjà du dioxygène. Est-ce que c'est afin d'en avoir plus pour la réaction ?
Merci d'avance de votre réponse.
-----