Bonsoir
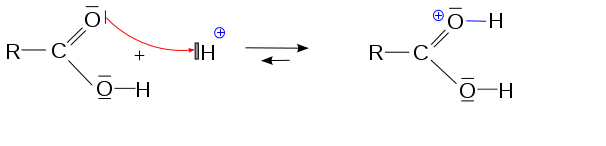
Je suis en P1 médecine et j'essaie de comprendre le processus d’estérification et notamment la première étape à savoir une protonation : l'acide carboxylique capte un H+ du milieu acide grâce à un de ses doublets non liants.
Cependant par la suite le O porte une charge + que je n'arrive absolument pas à comprendre : certes l'oxygène cède un e- au H+, mais cet e- est par la suite remis en commun alors pourquoi l'oxygène porte-t-il cette charge ? En comptant le nombre de doublets liants/non liants à disposition de l'oxygène on trouve bien 4 à savoir 8 e- donc la règle de l'octet est respectée non ? Je ne sais pas si je ne trouve pas la solution parce qu'elle est compliquée ou parce que ça fait 2 heures que je reste coincé dessus et j'ai la tête en choucroute.
-----