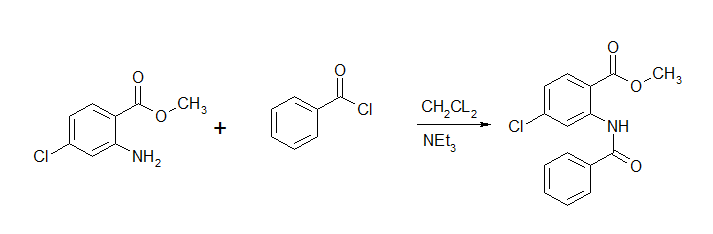
salut tous le monde j'ai quelque difficultés dans une synthèse d'un amide la réaction bilan est ci-dessous un amino benzoate avec un chlorure d'acyle dans le dichlorométhane aprés une heure de réflux j'ai ajoutée la triéthylamine et j'ai suivie la réaction avec la CCM quand la réaction et terminée j'ai filtrée et vérifier la purtée avec la CCM le problème et que notre produit (cristaux) n’apparaît pas dans l'UV donc il n'absorbe pas dans l'UV donc c'est pas un produit organique donc c'est pas notre produit ...
(je pense que c'est est un sel! (CL-,+NEt3) )d'un autre coté le filtrat présent une grande tache. donc notre produit et dans le filtrat (c'est un liquide?) comment je peut récupérer mon produits.et merci d'avance

-----



