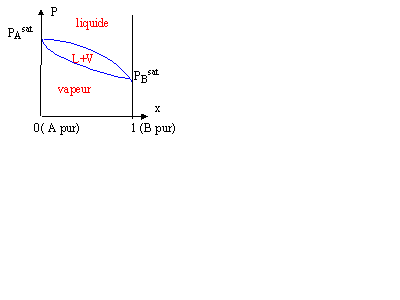
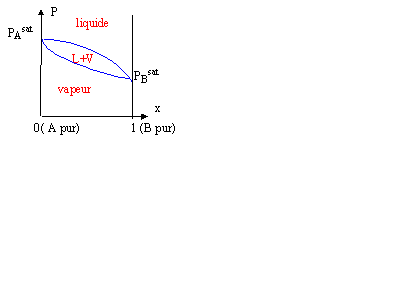
Bonsoir,
j’aimerai avoir quelque elairssissement au sujet des équilibres des mélanges (binaire) aussi bien liquide-vapeur que solide-liquide.
1)tout d’abord lorsqu’on parle d’équilibre : est ce qu’on a deux phases distinctes par exemple une phase liquide est une phase solide qui sont en équilibre, ou bien a-t-on une seul phase homogène ou cohabite du liquide+solide ? (même chose pour liquide vapeur) ?
2)a priori j’arrive à manipuler la notion de pression de vapeur saturante mais j’aimerais avoir une définition plus concrète (physique) ?
merci bien.
-----