Tu as donc bien du HCO3- en solution avant de commencer le dosage. D'ailleurs si tu regarde bien ton énoncé on te demande d'exprimer la quantité de CO32- et HCO3- au début du dosage.
-----

Tu as donc bien du HCO3- en solution avant de commencer le dosage. D'ailleurs si tu regarde bien ton énoncé on te demande d'exprimer la quantité de CO32- et HCO3- au début du dosage.


D'accord mais du coup comment indiquer ces concentrations ?
Et quel rapport avec les H+ ?

C'est à toi de le dire


Pour le CO3 2-, on a n0=Cb*Vb
On a x mole de CO2
Donc on a n0+x mole de HCO3- ?

As-tu fais un tableau d'avancement ?


Oui mais je crois bien qu'il est faux !

Présente donc ton tableau d'avancement. Essaye de donner le maximum d'infos pour que l'on puisse t'aider. Comment savoir où tu bloques si on ne sait pas ce que tu as fait ?


J'ai mis dans mon tableau la réaction CO2 + CO3 2- + H2O => 2HCO3-
état initial n0=cb*vb x n0+x
(Je n'arrive pas à espacer en colonnes)
CO2 : n0=cb*vb
CO3 2- : x
2 HCO3- :n0+x

Je te conseille de te replonger dans ton cours et de revoir la signification d'une équation chimique et la réalisation d'un tableau d'avancement. Ce sont des notions que tu ne sembles pas maîtriser.


Je veux bien mais nous n'avons fait aucun cours là-dessus, on doit préparer un TP sur lequel on a pas fait de cours du tout.
Je sais faire un tableau d'avancement de ce type :
Mais je n'arrive pas l'adapter à cet exercice.


Si je remplis jusqu'au bout,
à l'état final, on aurait :
pour CO3 2- : n0-xmax
pour CO2 : x-xmax
et pour HCO3- : xmax !


Donc au début du dosage, on a n0-xmax mole de CO3 2-, si la réaction est totale, on a n0-xmax=0 donc xmax=n0=cb*vb
donc on a [HCO3-]=xmax=cb*vb
On a donc autant de mole de CO3 2- que de mole de HCO3- au début du dosage.
Par contre je ne vois pas du tout comment faire pour les H+ ajoutés.

J'ai l'impression que tu mélanges la réaction avec CO2 et la réaction de dosage. Dans un premier temps concentre toi sur la première. Attention également, une réaction totale ne signifie pas que tous les réactifs ont été entièrement consommés. Enfin, tu ne prends pas en compte les coefficients stchiométriques.


Exact, donc au début du dosage, c'est-à-dire à la fin de la réaction avec le CO2, on a 2 fois plus de mole de HCO3- que de CO3 2-.

Non ce n'est pas ça. On a deux fois plus de moles de HCO3- produit que de CO32- consommé.


Voici le tableau que j'ai fait au brouillon :
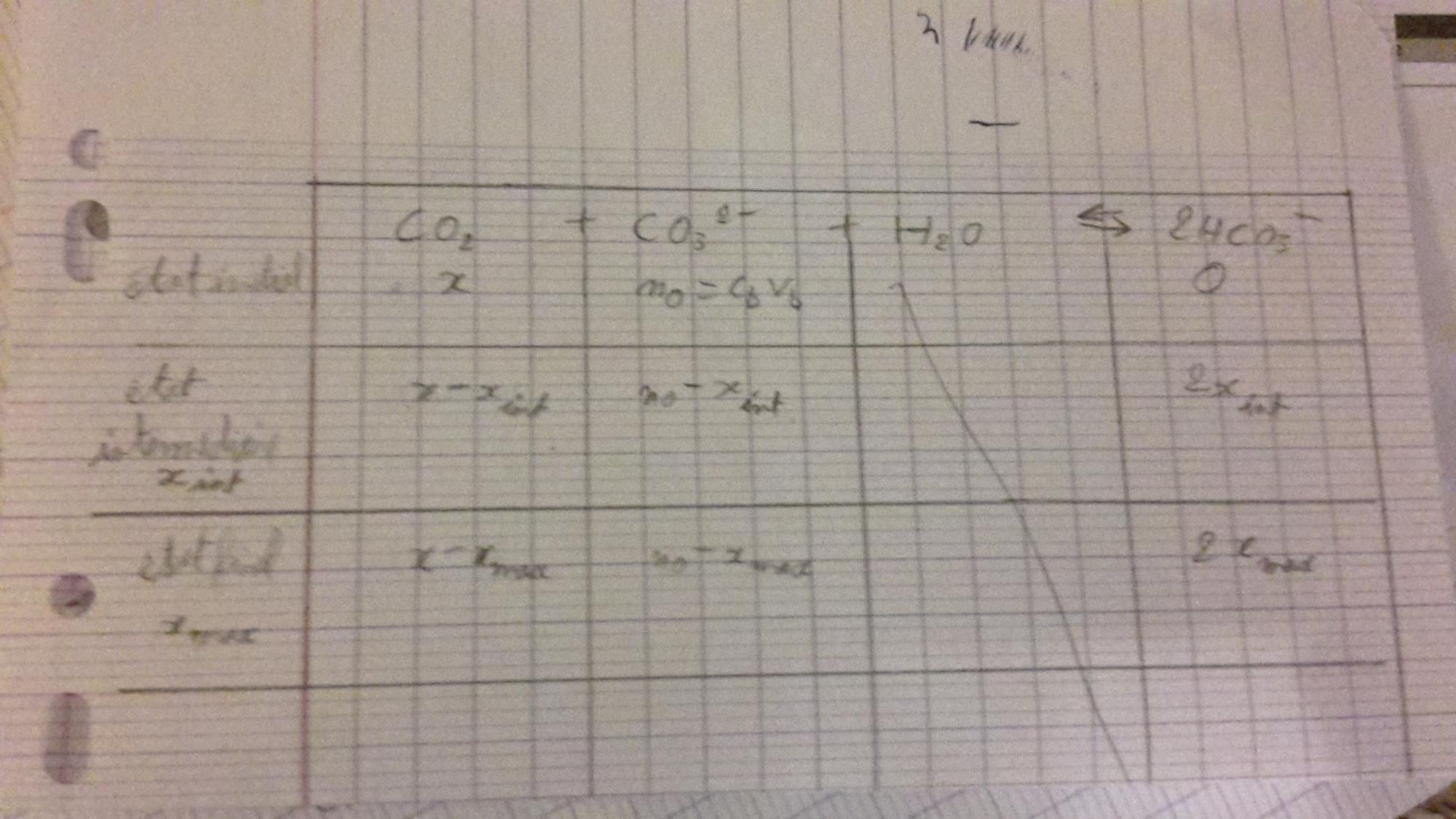


Oui c'est ce que je voulais dire : 1 mole de CO3 2- donne 2 moles de HCO3- , non ?
Mais du coup, comment exprimer le nombre de moles de H+ ?

Il faut écrire les équations des réactions entre H+ et les espèces en solution.


Ces équations sont-elles utiles ?
CO3 2- + H3O+ => H2O + HCO3-
et HCO3- + H3O+ => 2 H2O+ CO2



Oui : les espèces présentes au début du dosage vont réagir avec les ions H+ présent dans l'acide chlorhydrique.
Or, ces ions ne peuvent exister seuls, ils sont donc sous la forme H3O+
On obtient donc les équations que j'ai dit.
La première correspond à la première équivalence et la seconde à la deuxième équivalence.
Cependant, une fois que l'on a cela, comment exprimer le nombre de moles de H+ ?

C'est toujours le même principe. Tu as les équations des réactions, tu connais donc les relations entre les quantités de matière des réactifs/produits. Tu peux faire un tableau d'avancement.


D'accord, c'est ce que je pensais, mais du coup, il faut faire 1 tableau par équation ?

Comment veux-tu faire un seul tableau d'avancement pour deux réactions ?


Oui oui, je voulais être sure !
Pour la 1ère équation
à l'état initial, on a :
[CO3 2-]=n0 d'après ce qu'on a fait avant mais comment exprimer [H3O+] en fonction de n0 et x puisqu'il fait partie des réactifs et non des produits ?
Pour la 2ème éqution
à l'état initial, on a :
[HCO3-]=2n0 même question


Je me rends compte que les équations que je t'ai dit hier soir sont celles du premier dosage (celui où il n'y a pas de CO2)
Mais alors, quelles sont les équations du second dosage ?


Je remonte !
Je suis toujours bloquée sur le choix des équations pour le second dosage afin d'exprimer la quantité de H+.

Pourquoi ces équations ne pourrait pas être celles du deuxième dosage ? Tu as bien du CO32- et du HCO3- en solution.


Oui c'est vrai ! Mais je pensais qu'ils ne réagissaient pas chacun à leur tour.


Est-ce qu'à la fin de la question pour les H3O+, on trouve qu'on en a ajouté en tout 2n0 ?
Je trouve ça bizarre car on devait exprimer cette concentration en fonction de n0 et x, or nous n'avons que n0...

