Bonjour,
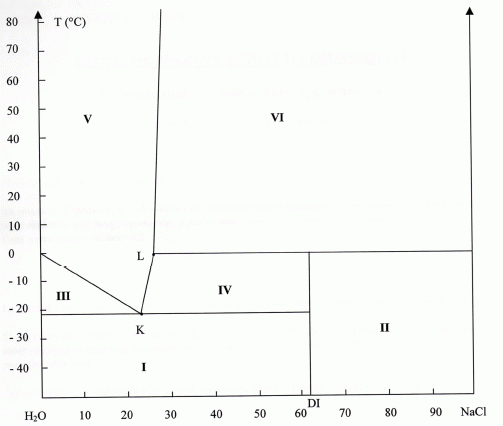
Je suis entrain de travailler sur un diagramme binaire H2O - NaCl pour une pression de 1 bar
DI correspond au dihydrate NaCl, 2H2O
Je cherche à identifier les 6 zones. Je n'arrive à identifier les zones I et IV ainsi que le point peritectique en L
Pouvez vous m'expliquer ce qui se passe dans ces 2 zones et au point peritectique car j'ai du mal a comprendre. la correction est deja sur le net. Mais les explications ne sont pas claire http://www.chimix.com/an10/cap10/capesa11.html
merci pour votre aide.
-----