Bonjour
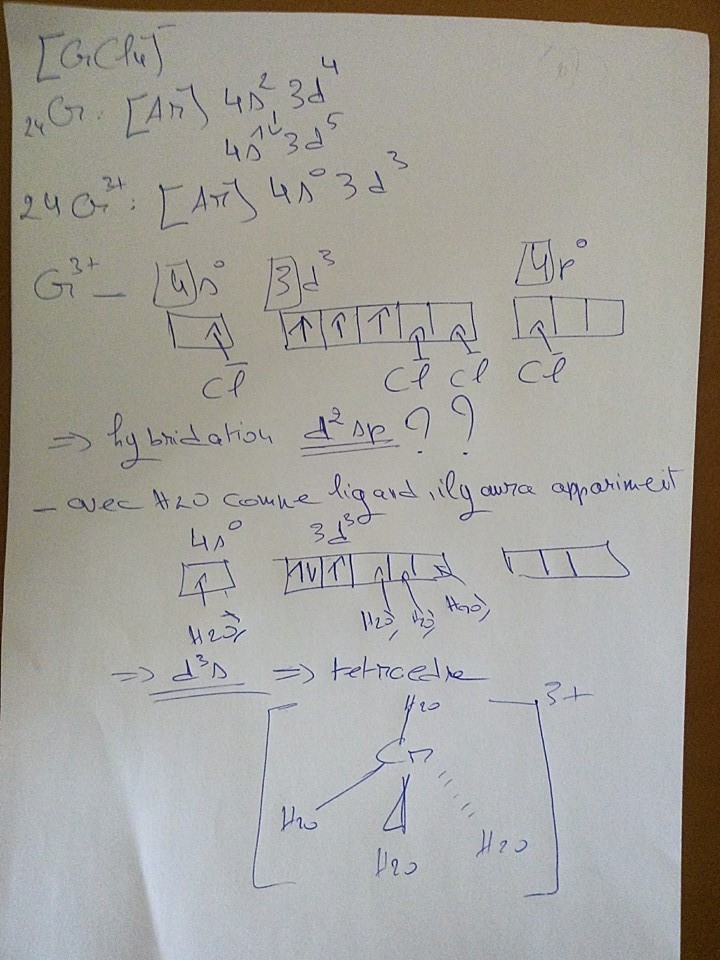
dans la question 2: il me demande de représenter ces 2 complexes dans l'espace..
pour faire ça il faut passer par la théorie de la liaison de valence pour déterminer l'hybridation..
selon les donnes de l'exercice le chlore est un ligand a champ faible , l'eau a champ fort
alors problème 1
ce que j'ai trouvé pour le premier complexe (ion tétrachlorure chromate)
une hybridation d2sp, est ce que cette hybridation existe?
ce que j'ai étudié c'est sp3 ou d3s pour les tétraèdres et dsp2 pour les carré
problème 2:
pour le 2éme complexe est ce que je fais l’appariement?
car c'un ligand a champ fort , dans ce cas je vais obtenir d3s
si je fais pas , je vais obtenir le même cas que le premier d2sp
et merci
-----