Bonjour
je suis en train de travailler sur des analyses à la microsonde de cassitérite et j'aimerais bien savoir comment je pourrais séparer le FeO mesuré en wt % fer ferreux et fer ferrique.
Merci davance
-----


Bonjour
je suis en train de travailler sur des analyses à la microsonde de cassitérite et j'aimerais bien savoir comment je pourrais séparer le FeO mesuré en wt % fer ferreux et fer ferrique.
Merci davance

Salut,
il est plus facile de repondre a cette question quand on a tout les donnes devant soit. Neanmoins, il faut verifier plusieurs choses :
- le total de ton analyse : voir si ca tombe a plus ou moins 100% ou si c'est moins (je calculerais plutot ce total avec Fe2O3 plutot que FeO) . Si c'est le cas, c'est que tu as de l'eau dedans; en l'occurence, dans le cas de la cassiterite, des groupements OH- en substitution de O= et donc le fer est bien la pour equilibrer ce manque de charges negatives.
- L'equilibre des charges : Je pense, mais il faut reverifier, que le couple Sn2+-Sn4+ ne joue pas de role dans la cassiterite. Ton equilibre des charges ne sera donc maintenu que par Fe2+-Fe3+ et O=-OH-. Il faut donc calculer le bon rapport pour obtenir une composition neutre.
- L'hydratation : le calcul devrait theoriquement se faire par difference sur 100% mais c'est a prendre avec des pincettes; ca marche pas toujous tres bien. Ce sera le dernier truc a calculer quand tu auras tes rapports Fe2+/Fe3+
Juste un note supplementaire si tu arrives dans le domaine de la varlamoffite (Sn,Fe)(O,OH), ou Fe/(Sn+Fe)>30%, c'est un peu plus complexe, le Sn2+ est peut etre bien present, et les rapports ne sont plus tres stoechiometriques. L'etude de la varlamoffite est d'ailleurs en cours pour le moment car le mineral est considere comme "douteux" par l'IMA.
T-K
If you open your mind too much, your brain will fall out (T.Minchin)


Salut,
je te remercie, je vais essayer de calculer quelquechose avec ce ke tu m'as dis. Je met le tableau que j'ai, si jamais ça peut t'aider pour me donner les meilleurs conseils possibles.
Merci

Bin ca, c'est la meilleure... l'image n'est pas encore validee mais je vois Cassiterite et Montebras, j'ai fais ma these de DEA sur Montebras, entre autres....si ca peut t'interesser....c'est plutot oriente mineralogie des phosphates mais bon.....
Si : "Les sequences d'evolution des phosphates d'aluminium dans les pegmatites granitiques : Le cas de Montebras (Massif Central, France)" t'interresse, je peux toujours te l'envoyer en pdf !!!, fais le moi savoir par MP !
T-K
If you open your mind too much, your brain will fall out (T.Minchin)

J'ajoute, puisque ca vient de Montebras que ces cassiterites sont pleines de niobium et de tantale. Dans ce cas, le rapport Fe2+-Fe3+ est egalement contrebalance par la presence de Nb5+ et Ta5+. la substitution O=-OH- et le rapport Fe est moins important.- L'equilibre des charges : Je pense, mais il faut reverifier, que le couple Sn2+-Sn4+ ne joue pas de role dans la cassiterite. Ton equilibre des charges ne sera donc maintenu que par Fe2+-Fe3+ et O=-OH-. Il faut donc calculer le bon rapport pour obtenir une composition neutre.
Pour le reste, j'y jetterais un coup d'oeil ce soir...
T-K
If you open your mind too much, your brain will fall out (T.Minchin)

J'ai calcule le premier groupe (MB1) sur une base d'un cation, voila une moyenne des resultats (vu les variations en tantale, je suppose que tu sais ce que tu as shoote a la sonde...)
(Sn0.94Ta0.02Nb0.02Fe2+0.01)0.99O2
Sn4+ : 0.936(26)
Fe2+ : 0.012(7)
Mg2+ : 0.002(1)
Mn2+ : 0.003(2)
Ta5+ : 0.020(11)
Nb5+ : 0.022(11)
Ti4+ : 0.004(3)
Total : 1.000
Charges : 4.007(8)
ou la deviation standard est entre parentheses.
Dans ce cas-ci, il n'est pas necessaire de mettre du fer(III) a la place du ferreux, mais dans d'autres cas ca peut arriver si le total de charge est <4.00
T-K
If you open your mind too much, your brain will fall out (T.Minchin)


salut Tawahi-Kiwi, tu est en géoscience par hasard?

Non, je suis marchand de poireaux aux iles Kerguelen.....
hum, plus serieusement, ce n'est pas a moi qu'il faut demander des infos sur les etudes de geologie en France; je les ai fait en Belgique avant Bologne et je ne suis plus dans le coin pour le moment, j'aurais donc du mal a te conseiller.
T-K
If you open your mind too much, your brain will fall out (T.Minchin)


Salut!!!
C super de m'aider !!!
Par contre, quand je refais le calcul de charge je trouve 4 pile et pas 4,007, j'imagine que c avec tous les chiffres après la virgule que tu trouve ça.
Donc tu dis que quand c'est inférieur à 4 on peut rajouter du Fe3+
Imaginons que la charge est de 3,998, il manque donc 0,002 de charge: si on a 0,012 de Fe2+
cela fait 0,002/3= 0,000666...Fe3+
et 0,012-(0,002/3)=0,011333...Fe2+ si je suis ta logique
En tout cas merci pour tout

Si tu trouves 4.0000 tout pile a chaque fois, c'est que la base que tu as choisi est 2 oxygene.s...et le calcul des charges n'a alors pas de sens. Si 4.00 est une moyenne de toute tes valeurs, alors pas de probleme...
Tout depend de la calibration de la microsonde que tu as utilise mais generalement, pour les majeurs, on s'arrete a la deuxieme decimale; plus loin, c'est sous l'erreur de mesure; tu peux aussi utiliser les ecart-type de tes moyennes pour estimer la representativite de tes donnees. En consequence, si ton Fe3+ est inferieur a 0.01 a.p.u.f., laisse tomber, c'est pas la peine, ca ne represente rien.
Pour reprendre ton exemple maintenant, le but est d'equilibrer electriquement ta cassiterite en considerant qu'elle est de la forme X~1O2 => 4 charges. si ((Sn,Ti)4++(Nb,Ta)5++(Fe,Mn,Mg)2+ < 4.00, tu peux augmenter la somme des charges en remplacant ce qu'il faut de fer ferreux en ferrique. si la somme = 3.998 comme dans ton exemple, tu as besoin de 0.002 charges a partir de Fe2+ en Fe3+ => Fetot = 0.012; Fe2+=0.010; Fe3+=0.002, tout betement. (j'ai pas bien compris pourquoi tu divises par 3...).
T-K
If you open your mind too much, your brain will fall out (T.Minchin)


Salut!!!
en fait c tout bête pour pas dire autre chose ...
Je me complique la vie
Merci

Bonjour, cette discution remonte à un moment déjà mais je voudrais poser une question dans le même thème si vous me le permettez.
Alors voilà, dans mon cas, j'ai une analyse contenant FeO*= total iron as FeO
Je comprends que FeO*= (FeO+Fe2O3) et je voudrais les séparer car j'ai besoin du FeO pour la suite de mon étude et mes diagramme ainsi que pour calculer le Mg#
J'espère que quelqu'un verra mon message et pourra m'aider, je cherche depuis quelques heures déjà!
Merci

Salut,Bonjour, cette discution remonte à un moment déjà mais je voudrais poser une question dans le même thème si vous me le permettez.
Alors voilà, dans mon cas, j'ai une analyse contenant FeO*= total iron as FeO
Je comprends que FeO*= (FeO+Fe2O3) et je voudrais les séparer car j'ai besoin du FeO pour la suite de mon étude et mes diagramme ainsi que pour calculer le Mg#
J'espère que quelqu'un verra mon message et pourra m'aider, je cherche depuis quelques heures déjà!
si c'est un mineral, la formule doit etre recalculee pour assurer une charge neutre au mineral.
Si c'est un verre ou une roche totale, ce n'est pas possible sans information supplementaire (fO2 par exemple).
T-K
If you open your mind too much, your brain will fall out (T.Minchin)

Effectivement il s'agit de la composition de la roche totale et je ne dispose pas de la teneur en O2 !!
Merci de votre réponse.

Oui, sans un calcul sur base de la composition chimique de certains mineraux ou la presence d'un tampon, ca va etre difficile d'estimer fO2
T-K
If you open your mind too much, your brain will fall out (T.Minchin)


Bonjour à tous je suis confrontée au même problème je travaille sur des analyses de microsonde sur minéraux opaques et je n'ai que FeO de dosé comment arriver à calculer FeO et Fe2O3 pour pouvoir séparer mes opaques et classer surtout que pour la plupart c'est des solutions solides. Merci à vous

Bonjour et bienvenue sur les forums Futura-Sciences,
comme expliqué dans les messages précedents, les parametres a verifier sont le total de l'analyse, l'équilibre des charges et l'hydratation potentielle.
Le plus souvent, il s'agit d'équations avec un nombre plus grand d'inconnues que de donnees numériques, il est donc recommandé d'avoir une vague idée des minéraux opaques observés (au travers de l'observation microscopique des morphologies, lumiere refléchie, type de roche, état d'oxydation et d'alteration, stoechio approximative etc.).
Vu que tu parles de solution solide, je suppose qu'il s'agit d'oxydes de Fe & Ti. Avec du titane present, soit c'est un membre de fin de serie (ilmenite, ulvospinel, pseudobrookite) et une estimation stoechiometrique est suffisante pour le reperer (suivi ensuite d'une balance de charge), soit c'est le long d'un des deux solutions solide possible (titanomagnetite ou hemoilmenite).
Dans le cas des titanomagnetite (serie spinelle), tu recalcules sur une base de 4 oxygenes (ou 8 charges), puis ajuste les proportions Fe2+/Fe3+ sur base de la balance des charges électriques.
Dans le cas de l'hemoilmenite (serie corindon), tu recalcules sur une base de 3 oxygenes (ou 6 charges), puis ajuste les proportions Fe2+/Fe3+ sur base de la balance des charges électriques.
Si tu ne sais pas a quelle série cela appartient, tu utilises les deux bases d'oxygenes (3 et 4), et compte ensuite le nombre de cations par unité formulaire que tu obtiens apres calcul. Celui qui te donnes un nombre ±entier est la correction solution solide (2 cations pour les hemoilmenite; 3 cations pour les titanomagnetites).
Les deux séries étant anhydres, cela simplifie considérablement le probleme.
Dans le cas hydraté, le mieux, avant toute chose, est de recaluler l'analyse en Fe2O3 et verifier le total obtenu. Si c'est inferieur a 100 wt.%, il est probable qu'une partie des anions sont des hydroxyles et que de l'eau soit presente.
T-K
Dernière modification par Tawahi-Kiwi ; 31/10/2017 à 03h02.
If you open your mind too much, your brain will fall out (T.Minchin)

Dans le cas ou l'on voudrait calculer Fe2+ et Fe3+ a partir de Fe2O3 comment doit-on faire ? sachant qu'on est dans le cas d'un pyroxéne no'malisé a 6 oxygéne

Salut,
Si la normalisation est faite sur 6 oxygenes, il y a 12 charges electriques disponibles. Il faut donc s'assurer que la somme des charges cationiques est egales a 12.
Si le fer est exprime en Fe2O3, la somme totale des charges est surestimee (superieure a 12 ici) puisque tout est considere comme Fe3+.
Il faut donc considerer qu'une partie de ce Fe3+ est en fait 2+ pour s'assurer que le mineral est electriquement neutre.
Si on veut recalculer les masses de Fe2O3 et FeO en wt.%, il suffit de faire le calcul en sens inverse une fois les quantites p.f.u. de Fe3+ et Fe2+ estimees.
T-K
If you open your mind too much, your brain will fall out (T.Minchin)

Justement je n'ai pas su m y prendre afin de calculer FeO, Fe2+ et Fe3+.
pouvez vous svp m'expliquer par qu'elle formule je peux calculer
merci

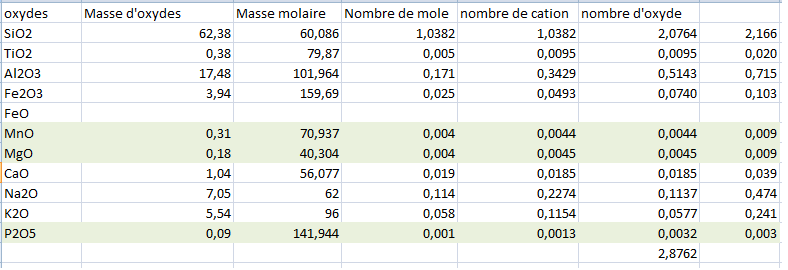
En premier il faut calculer la somme des charges electriques cationiques: Si4++Ti4++Al3++Fe3++Mg2++Mn2++Na+ +Ca2++K++P5+. La somme que tu devrais obtenir avec l'analyse du message #18 devrait etre 12.042 charges positives p.f.u.
Un pyroxene ideal calcule sur 6 oxygenes devrait avoir 12 charges positives. On a donc 0.042 charge de trop, qui est du au fer calcule comme Fe3+
Fe.p.f.u. est 0.103. Vu qu'on doit reduire la charge electrique de 0.042, cela signifie qu'en realite, il y a 0.042 Fe2+ et 0.061 Fe3+.
De ces deux donnes, il faut repartir en arriere pour recalculer Fe2O3 et FeO en appliquant les memes formules et rapports que tu as applique pour arriver a la formule structurale.
T-K
If you open your mind too much, your brain will fall out (T.Minchin)

Je remarque juste a l'instant que l'analyse que tu donnes n'est absolument pas un pyroxene....
Je ne sais d'ailleurs pas trop ce que c'est.... de l'anorthoclase, ou une mauvaise analyse? quel est la repetabilite?
T-K
Dernière modification par Tawahi-Kiwi ; 21/04/2018 à 17h52.
If you open your mind too much, your brain will fall out (T.Minchin)

