Bonjour,
Je suis en 2e année d'école d'ingénieurs en mécanique, que j'ai intégrée après une CPGE PTSI-PT. J'effectue actuellement mon premier stage, qui porte sur la conception d'un compresseur de dihydrogène.
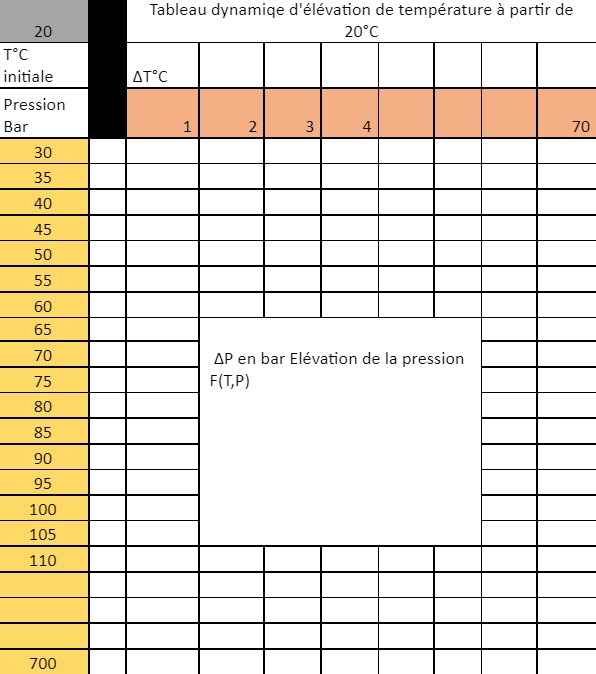
On m'a demandé d'établir un tableau présentant l'élévation de pression d'un gaz en fonction de la pression initiale, de la température initiale et de l'élévation de température imposée au gaz.
Il se présente ainsi :
Le 20 de la case grise correspond à la température initiale du gaz en °C.
Pour remplir le tableau, j'ai fixé un volume, puis une quantité de matière à partir du volume molaire du gaz, et ai utilisé la formule suivante que j'ai déduite de la loi des gaz parfaits.
DeltaP = n*R*DeltaT/V
J'ai immédiatement conclu que la variation de pression était indépendante de la pression initiale. Dans le tableau, les résultats sont donc les mêmes sur toutes les lignes. Mon tuteur n'a pas contredit cela.
D'après moi, la variation de pression ne dépend pas non plus de la température initiale, d'après ce modèle. J'ai donc dit à mon tuteur que le 20 °C de la case grise n'avait pas d'influence. On m'a pourtant dit que dans la pratique, la température initiale avait une forte influence sur la variation de la pression.
Je veux bien l'entendre, mais je ne sais pas comment le justifier et comment établir un modèle plus proche de la réalité. J'aimerais savoir si certains d'entre vous ont une explication à cela ? Est-ce une loi qui découle de la loi des Gaz Parfaits ? Est-ce un tout autre modèle ?
Je vous remercie par avance.
Merci beaucoup !
-----