Bonjour à tous ! Je viens de m'inscrire sur ce forum parce que j'avais vraiment besoin de vous mais je lis depuis bien longtemps les différents topics étant donné que mes problèmes sont bien souvent ceux d'autres personnes. J'en profite donc pour féliciter toutes les personnes qui font vivre ce forum.
Parenthèse fermée, j'en viens à mes questions.
J'suis en 3eme année de licence de chimie et j'ai un exam de chimie inorganique demain soir. J'suis donc en train de refaire les exams des années précèdentes et certaines questions me posent problème même avec mon cours et internet...
C'est peut-être pas compliqué mais je bloque sur certains trucs, donc si quelqu'un pouvait m'aider...
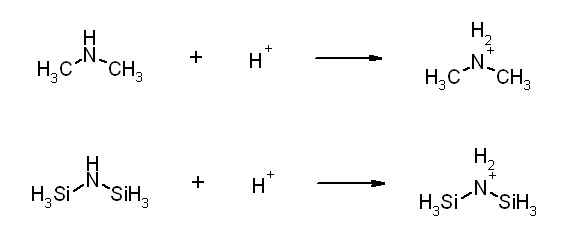
Premièrement, on me demande d'expliquer pourquoi N(CH3)3 est une meilleure base de Lewis que N(SiH3). Dans un autre exam on me demande d'expliquer pourquoi BCl3 est un meilleur acide de Lewis que BF3 et dans le dernier exam, pourquoi AlCl3 est un meilleur acide de Lewis que AlF3.
Impossible de comprendre pourquoi... Peut-être qu'il faut utiliser le principe HSAB de Pearson mais j'vois pas comment on va pouvoir l'utiliser.
D'autre part on me demande pourquoi le point de fusion du potassium est plus faible que celui du fer.
Il doit y avoir une raison simple mais impossible de la trouver. Rayons des atomes ? Electronégativité ? Charge effective ? Aucune de ces caractéristiques ne semblent prouver un pt de fusion plus élevé.
Enfin, on me demande pourquoi les solutions aqueuses (non acidifiées) de FeCl3 ne sont pas conductrices.
En espérant que tout ça vous dise quelquechose... Même si vous n'avez pas la réponse exacte, donnez moi juste des pistes, elles m'aideront grandement j'en suis sûr !
Merci d'avance ! Bonne journée !
Jonathan
-----