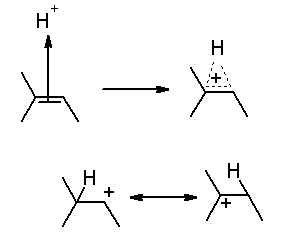
Bonjour a tous,
La regle de Markovnikov stipule que l'halogene (dans le cadre d'une hydrohalogenation) va se fixer sur le carbocation le plus stable de la double liaison C-C.
Mais, cela est possible car, en premier lieu, la double liaison a "attaqué" le H(+) de la liaison H-X (avec X l'halogene). Et c'est le carbone le moins substitué qui attaque.
Or, plus un carbone de la double liasion d'un alcene est substitué, plus il est réactif.
de ce fait, pourquoi est ce le carbone le moins réactif de la double liasion qui effectue la premiere réaction, avec le H(+)?
-----