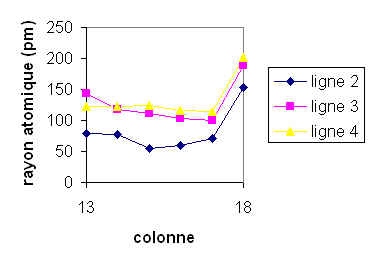
Bonjour,
On sait que le rayon atomique augmente lorsqu'il y a des orbitales supplémentaire autour de l'atome et il diminue lorsque l'orbitale contient de plus en plus d'électrons.
Cela dit lorsque l'on passe du 7ème groupe (les hallogènes) au 8ème groupe (les gaz rares) on reste sur la même orbitale, il y a une électron en plus sur l'orbitale entre le 7ème groupe et le 8ème groupe mais le rayon augmente...
Savez vous pourquoi? j'ai beaucoup cherché mais je n'ai jamais trouvé la réponse...
Merci d'avance.
-----