bonjour
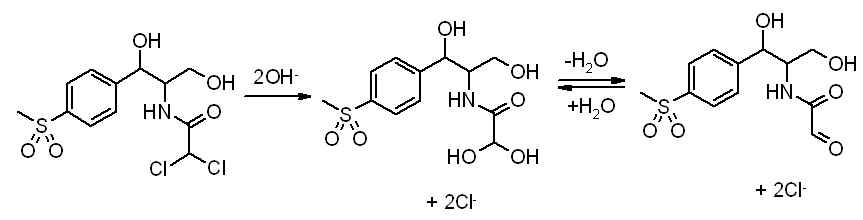
voici en gros le titrage du thiamphénicol :
dissolvez X g de thiamphénicol dans Xml d'éthanol à 96%
on ajoute 20ml de KOH à 500g/l et l'on le porte à reflux pendant 4h.
ensuite on ajoute 100ml d'eau et on neutralise par de l'acide nitrique dilué R. puis on ajoute encore 5ml en excès.
on titre ensuite par le nitrate d'argent 0,1M
voila , j'ai quelques petits problèmes de compréhension avec ce titrage:
-étant donné que le pKa du thiamphénicol est de 9,76 on réalise sont titrage en milieu alcool car c'est une base trop faible que pour titré en milieu aqueux c'est bien ça?
-on met du KOH et on porte à reflux, c'est pour mettre toute la molécule sous une forme non? mais laquelle?
- l'acide nitrique ne va que neutraliser le KOH ou il va faire autre chose?
et enfin le nitrate d'argent va donc servir a titrer le tiamphénicol?
un grand grand merci pour c'est quelques précisions!
-----