Bonjour à tous,
Je planche pour le moment sur un article traitant de la synthèse de la molécule "przewalskin".
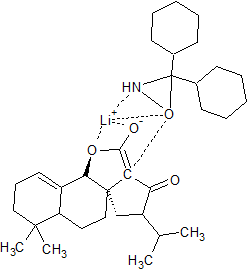
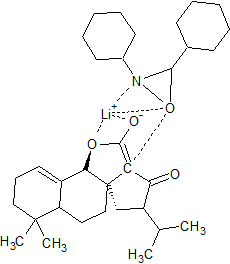
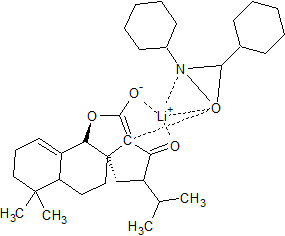
Dans cette synthèse se trouve une réaction INAS (intramolecular nucleophilic acyl substitution) et je n'arrive pas (après pourtant 1 semaine de recherche) à trouver le mécanisme de cette réaction.
Je vous mets ci-joint les deux molécules (celle de départ (où se trouve un atome d'iode) et d'arrivée (où l'on a formé un cycle supplémentaire). Si vous avez une idée ou surtout une source vers laquelle me diriger pour comprendre cette réaction, cela serait super sympa.
INAS1.png molécule de départ...
INAS2.png molécule finale...
Merci d'avance,
Quentin
-----