Bonjour à tous et à toutes,
J'écris pour la première fois sur ce forum !
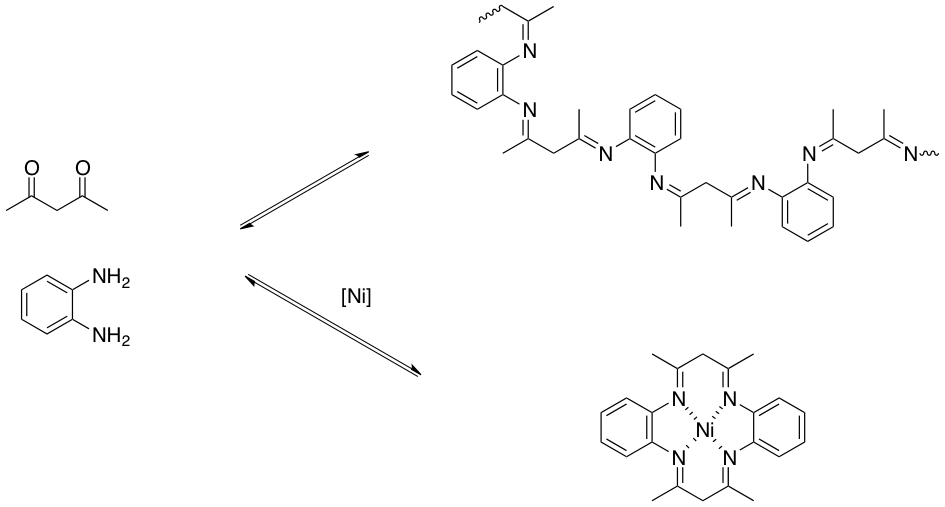
Alors mon problème c'est que je ne trouve pas la formule du complexe de Nickel NiMac, sa m'énerveeeeee car si je ne connais pas sa je ne pourrais pas faire mon tp :/
Donc si quelqu'un la connait ça serait gentil de me la dire
Merci d'avance !
-----