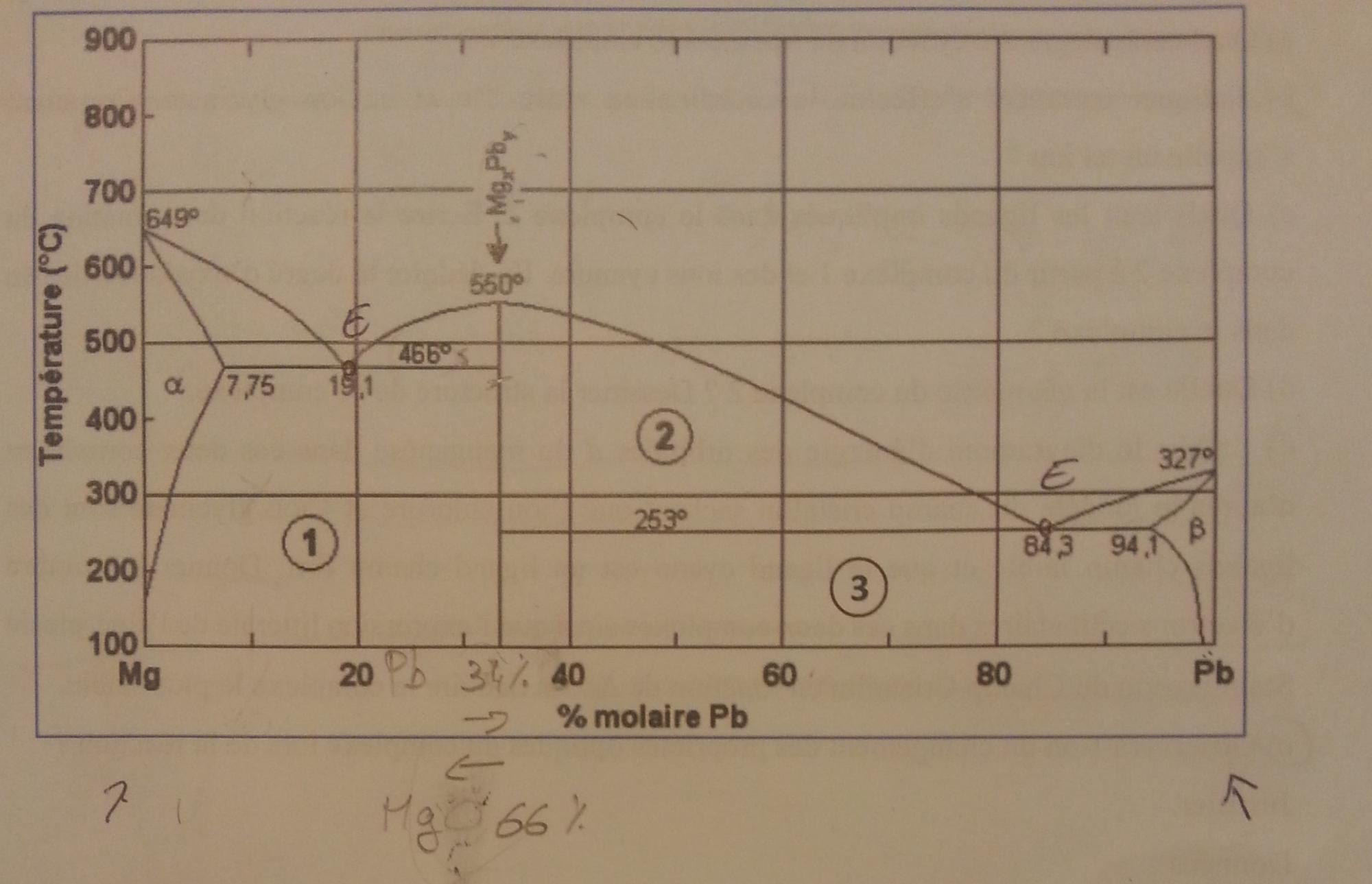
Bonjour j'ai une question concernant les diagrammes.
Tout d'abord j'aimerai savoir ce que c'est un point congruent ? j'ai cherché dans mon cours etc mais dans ma tete ce n'est pas tres claire. Je n'arrive pas à comprendre le truc.
Dans ce diagramme on me demande de trouver la formule chimique du composé MgxPby (au niveau de la fleche quand Pb=34%)
Au niveau de la fleche on voit que Pb=34% donc Mg=66%.
y de Pb = 2
x de Mg = 1
donc MgxPby represente Mg1Pb2
Est ce que c'est ça ?
Merci à vous et bon week end
-----