Bonjour à tous,
Je dispose d'une solution très acide (pH 0) contenant notamment une certaine concentration en fer ferreux (Fe2+), de l'ordre de 0,01M.
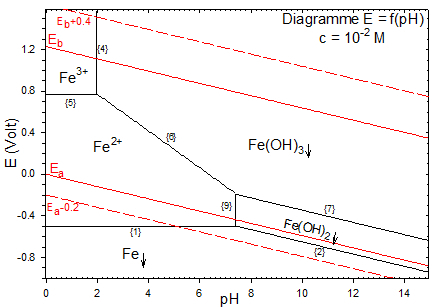
Afin de comprendre les réactions de précipitation pouvant se dérouler lors de la neutralisation de cette solution, je me suis basé sur le diagramme de Pourbaix du fer.
J'ai mesuré le potentiel redox de ma solution et celui-ci est de 0,550 V.
Je remarque qu'à ce potentiel redox, si je neutralise la solution en formant une ligne droite sur le graphique, je suis censé obtenir du Fe(OH)3 et non du Fe(OH)2. Cependant, je ne comprends pas comment le fer peut s'oxyder car dans ce cas-ci, un autre composé devrait être réduit et cela ne peut pas être l'eau au vu du potentiel redox.
Je vous remercie d'avance pour votre aide.
-----