(Re)bonsoir,
Encore une superbe question de ma part...
Deux questions mises côte à côte me posent problème.
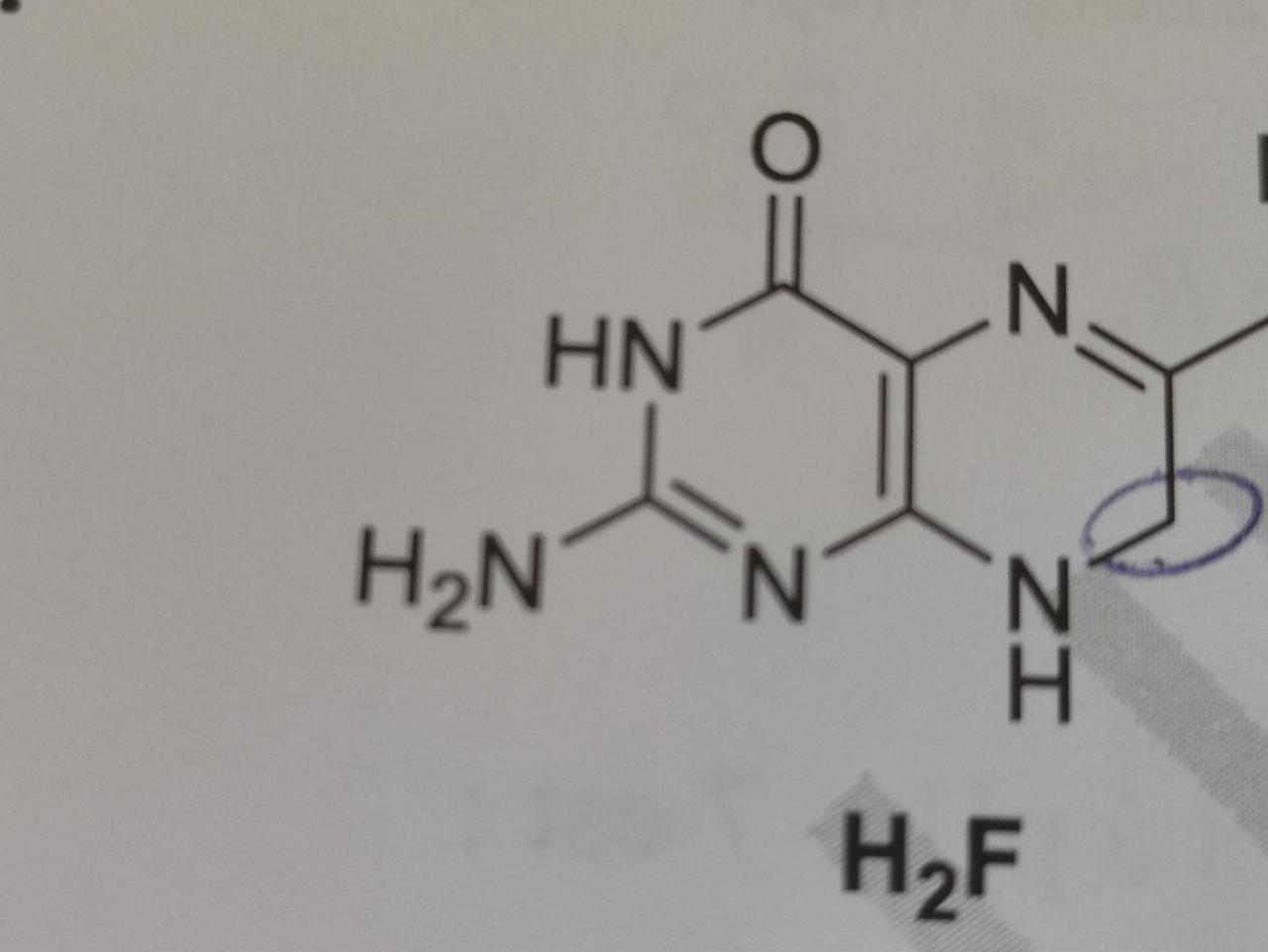
Dans la molécule suivante, on me demandait si
- les atomes C et N du bicycle sont dans le même plan
- le bicycle est un composé aromatique
La première est validée, la deuxième non. Or le critère d'invalidité de la deuxième est la géo sp3 du carbone (en bas à droite, à côté de NH), je suppose car DNL pas déloc.
Donc, étant donné que tous les autres sont sp2, pourquoi la première a été validée ?
Y a-t-il une différence de critère entre la recherche de la géométrie pour établir ou non l'aromaticité d'un cycle (cf Hückel : la molécule doit être plane) et pour établir si deux atomes sont dans le même plan ?
Je dois dire que je suis perdu;
Encore merci d'avance...
-----