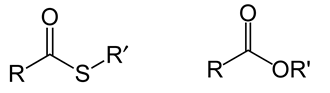Bonjour, bonsoir à tous !
Donc à ma gauche, un thioester et à ma droite un oxyester.
D'après un bon nombre de papier, l'oxyester est beaucoup plus stable que le thioester. Cependant, d'après ce bon nombre de papier : aucune explication sur la chose.
Alors d'après mes recherches, le thioester serait moins stable que l'oxyester, parce que l'atome de soufre est moins efficace dans la délocalisation des électrons. Ainsi, il ya moins de résonance de stabilisation du thioester par rapport à l'ester oxy.
Bon ça a l'air simple. J'ai rien compris.
Je ne comprends pas pourquoi il y'aurait moins de résonance de stabilisation ? On parle bien d'énolisation ? pcqe de mémoire l'ion énolate le plus stable serait le thioester non ?
Enfin bref, si quelqu'un peut m'éclairer ! je le remercie par avance grandement !
-----