Salut tout le monde, deux petits trucs me chagrinent dans un exercice avec l'équation chimique bilan, tableau d'avancement et la masse :
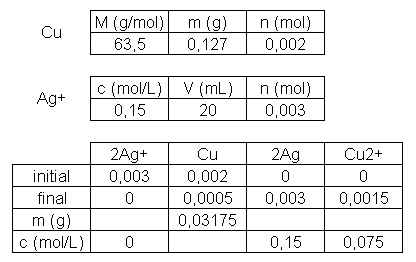
Voilà l'énoncé suivi de mes questions : "On verse dans un bécher V=20,0 mL d'une solution de nitrate d'argent contenant des ions argent (l) (Ag+(aq)) et des ions nitrate (NO3-(aq)), telle que [Ag+]=[NO3-]=0,15 mol/L. On y ajoute 0,127 g de poudre de cuivre. La solution initialement incolore devient bleue et il se forme un dépôt d'argent. Les ions nitrate n'interviennent pas dans la réaction.", ensuite ils disent de faire l'équation chimie, état initial du système en mol, trouver le réactif limitant et calculer l'avancement maximal, décrire l'état final du système en mol.
Donc tout ça j'ai fait donc on avait corrigé en cours et jusque là tout va bien j'ai trouvé tout pareil : équation chimique : 2Ag+(aq) + Cu(s) ---> Cu2+(aq) + 2Ag(s).
Malheureusement la dernière question du livre me laisse un peu perplexe, j'y ai répondu et j'ai bon mais j'ai pas compris un truc dans le cours et la masse, la question est :
"Déterminer, à l'état final :
-les concentrations molaires des ions en solution;
-les masses du (ou des) solide(s) présent(s)."
Donc voilà sur mon classeur quand on a corrigé en classe, on a calculé la masse du cuivre. Alors qu'on demande la masse des solides à l'état final, or je pense que le cuivre n'est pas solide après la réaction, lorsqu'il est réactif il est solide mais quand il est produit il est en ion non ?
Et pour finir pourquoi lorsque je calcule la masse du cuivre après avoir fait le tableau où je trouve 0,0005 mol, je ne trouve pas 0,127 g comme dit dans l'énoncé. Je veux dire que je calcule la masse du cuivre avec quantité de matière * masse molaire donc ça donne 0,0005*63,5=31 mg, mais dans l'énoncé y a écrot qu'on ajoute au début 0,127 g de poudre de cuivre alors pourquoi le résultat est différent ?
Merci d'avoir prit le temps de lire tout ça et de m'aider...
-----