Bonjour, j'ai un exercice de chimie que je n'arrive pas à faire ...
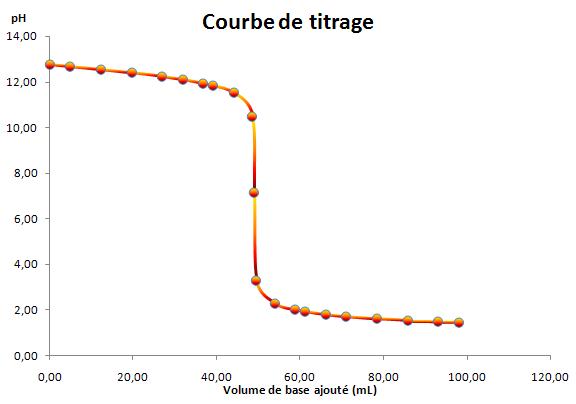
On dose Vo=50.0 mL d'une solution 1 de soude par une solution d'acide chlorhydrique de concentration Ca= 0.10mol/L. En présence de BBT, le virage du bleu au jaunbe se produit pour un volume de 49.1mL. Le volume mesuré est le même en présnce d'hélianthine ou de phénolphtaléine. Commentez cette observation . Quelle est la concentration Cb1 de la soude ?
Pour la concentration de la soude, c'est ok, je l'ai calculé et je trouve 0.10 mol/L
Par contre je ne comprend comment le virage se produit pour un même volume pour les trois indicateurs colorés sachant qu'ils n'ont pas du tout les même zones de virages ... Est-ce que quelqu'un voudrait bien m'expliquer svp ?
Merci .
Données: Zones de virage
phénolphtaléine : 8-10
BBT: 6-8
hélianthine: 3-4.5
-----