Bonjour
Je recherche à comprendre l'influence du CO2 dans l'abaissement du PH d'une eau.
Je vous remercie pour votre aide.
Voilà
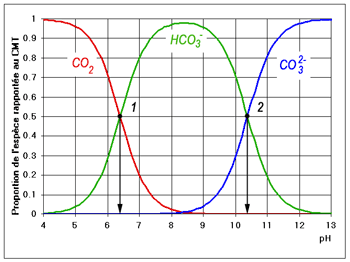
Suivant l'équilibre calco-carbonique d'une eau on a :
CaCO3 + CO2 + H2O ------- Ca(HCO3)2
Lorsqu'il y a un excès de CO2 dans l'eau (CO2 dit agressif) il y a dissolution du carbonate de calcium CaCO3 et il se forme (je peux me tromper)
CaCO3 + CO2 + H2O ----Ca2+ + 2HCO3
Je souhaiterai savoir à partir de cette sitution comment le CO2 en excès fait grimper le PH (eau agressive)
Une idée ?
Je pense que la monté du PH se passe à partir de la molécule 2HCO3En effet 2HCO3 donne H+ et HCO3-
Donc les H+ font grimpés le PH de l'eau. Je ne suis pas sûr ???
Je vous remercie pour votre aide.
-----





 ho ma tête, c'est juste une manière à moi de définir un C02 en excès dans l'eau.
ho ma tête, c'est juste une manière à moi de définir un C02 en excès dans l'eau.