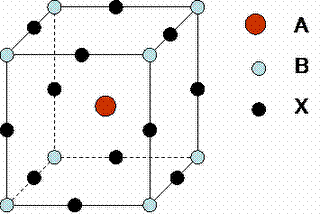
Bonjour, j'apprends les cours de chimie inorganique pour pouvoir passer dans ma filière de physique-chimie.
J'ai actuellement un problème: Je ne comprend pas comment trouvé sois-même un site octaédrique ou tétraédrique. (A moins qu'il ne faille l'apprendre par cœur)
-----




 . Oui ça j'avais commencer à comprendre, le truc c'est que j'ai eu beau chercher sur le forum, dans d'autre page web, sur mon propre ENT de ma FAC ainsi que les cours que l'on m'a passé.
. Oui ça j'avais commencer à comprendre, le truc c'est que j'ai eu beau chercher sur le forum, dans d'autre page web, sur mon propre ENT de ma FAC ainsi que les cours que l'on m'a passé.