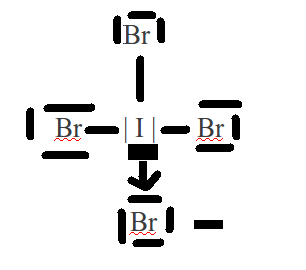
Bonjour à tous,
J'ai un problème avec la molécule IBr4 -.
En effet, je n'arrive pas à me la représenter.
Selon un corrigé il est dit que :
"3 des Br font des liaisons simples. Le dernier capte un électron et fait une liaison dative avec une case quantique vide de Br".
Premièrement, je ne comprends pas pourquoi il y aurait une liaison dative.
Deuxièmement, s'il y avait une liaison dative, cela impliquerait que la molécule ne serait pas chargée "-" mais "2-".
Sur internet, je n'ai rien trouvé.
Merci d'avance de votre aide.
-----