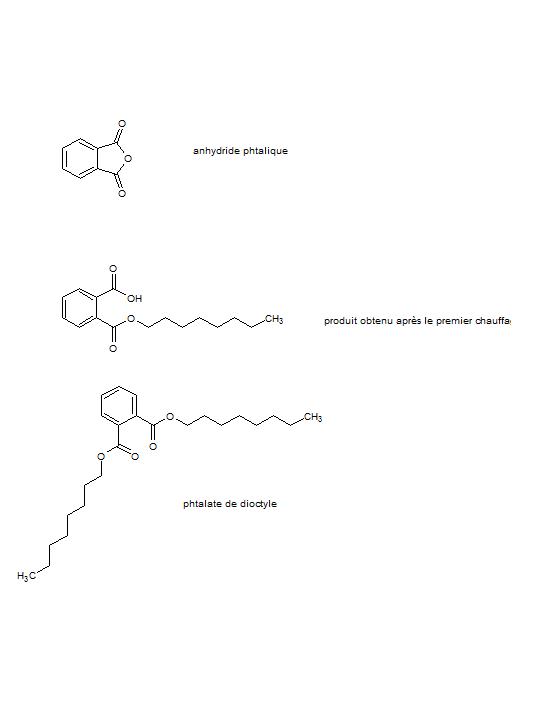
Bonjour,
j'essaye de comprendre ce qui s'est mal passé dans mon TP (synthèse du phtalate de dioctyle) mais j'ai du mal à trouver des réponses. je vous expose d'abord le protocole.
Dans un ballon de 100mL, verser 2.96g d'anhydride phtalique et 3.9g d'octan-1-ol. Ajouter un barreau aimanté, adapter un réfrigérant et chauffer à reflux pendant 1 heure à l'aide d'un bain de graphite.
A cet instant je pense qu'on obtient la molécule en pièce jointe.
Refroidir le ballon dans un bain d'eau froide jusqu'à température ambiante. Ajouter alors 2.6g d'octan-1-ol, o.1ml d'acide sulfurique concentré et 10ml de cyclohexane. Adapter un dean stark sur le ballon, calorifuger en l'enveloppant d'aluminium et chauffer jusqu'à ce que 0.4ml d'eau ait été récupéré dans le dean stark.
C'est au bout de quelques minutes de chauffage assez fort (comme la prof nous a dit de faire) qu'on sent une odeur de brulé et que l'on constate que le contenu du ballon est noir en enlevant l'aluminium.
Que s'est-il passé ? se pourrait -il SI il n'y avait pas de cyclohexane dedans, que le milieu "brûle" effectivement car il n'y aurait plus de solvant dedans ? (je demande car un autre groupe à eu le MÊME problème, à la MÊME paillasse mais cela n'a sûrement rien à voir avec le matériel)
-----