Bonsoir,
Voici un exercice sur l'acide sulfureux que j'ai effectué, j'aimerais savoir si mes résultats sont justes (il s'agit d'un contrôle que j'ai fait, après cet exo j'en mettrai 2-3 autres pour vous demander si vous voulez bien vérifier mes réponses, merci par avance !).
Problème
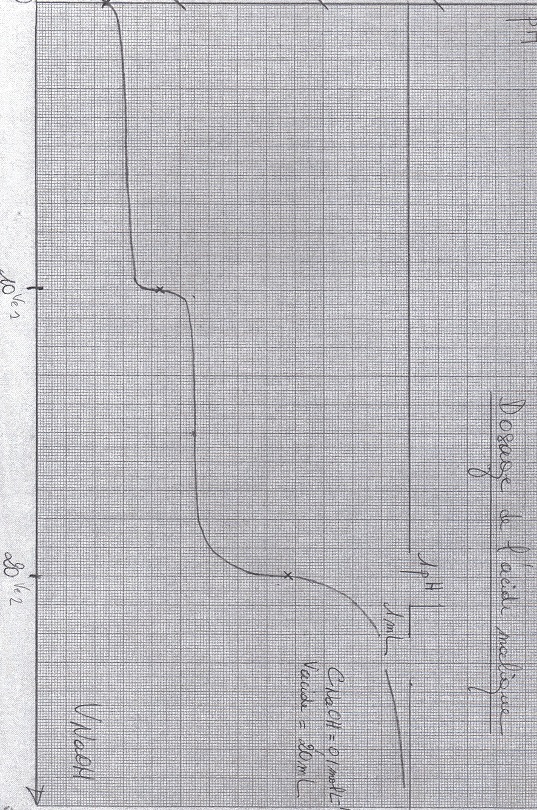
On dispose d'une solution d'acide sulfureux H2SO3, de concentration inconnue. On dose 20 ml de prise d'essai par une solution aqueuse d'hydroxyde de sodium de concentration Cb = 0,1 mol.L-1. On obtient la courbe donnée en annexe (je l'ai mise en fichier jointe. Alors je suis désolé, la vraie courbe était dans un format bizarre que j'arrive pas à intégrer sur le forum, du coup j'ai mis la courbe de dosage de l'acide malique, mais qui est très proche. Sur la vraie courbe, V1 = 8 ml de NaOH versé et V2 = 16 ml. pH à V1 = 4,5 et pH à V2 = 9,6. Encore désolé pour la petite pirouette...).
1) Déduire de la courbe les volumes équivalents V1 et 2.V1 correspondant à la neutralisation des deux acidités de H2SO3.
2) Donner l'équation de réaction entre l'acide sulfureux et l'hydroxyde de sodium entre V = 0 et V = V1.
3) Déduire de la courbe la concentration Ca de l'acide sulfureux.
4) Donner l'équation de réaction entre V = V1 et V = 2.V1
5) Donner la formule et le nom du composé formé à V = V1. Calculer sa concentration. Donner le pH à V = V1.
6) Idem pour V = 2.V1
______________________________ ______________________________
Réponses
1) V1 = 8 ml et 2.V1 = 16 ml
2) H2SO3 + NaOH -------> HSO3- + Na+ + H2O
3) J'ai effectué le calcul suivant : [C](acide sulfureux) = ([c](NaOH) * Ve) / V(acide sulfureux) = (0,1 * 8) /20 = 0,04 mol.L-1.
4) HSO3- + NaOH -------> SO32- + Na+ + H3O+
5) HYdrogénosulfite, avec formule qui est le produit de la réaction de la question 2. Je n'ai pas réussi à calculer la concentration par contre. Et pH, graphiquement, de 4,5 (comment le trouver par le calcul ?).
6) Sulfite, avec formule du produit trouvée à la question 4. Idem, pas de concentration et pH = 9,6 graphiquement.
-----




