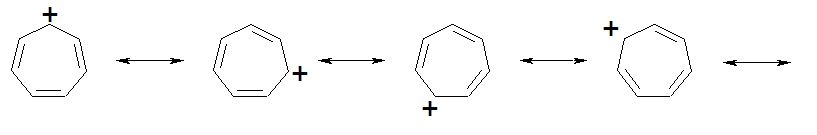
Bonjour à tous , pourquoi le cyclopropénone est plus stable que le cyclopropane alors que la tension dans le cycle est accrue pour les 2 ?
C'est dans une partie de mon cours de chimie aromatique.De plus , je ne suis pas sûre de comprendre , je connais la règle 4n+2e- délocalisable donc si n = 2 , il faut 6 électrons , mais alors , porquoi le cycloheptatriène n'est pas aromatique ???
-----