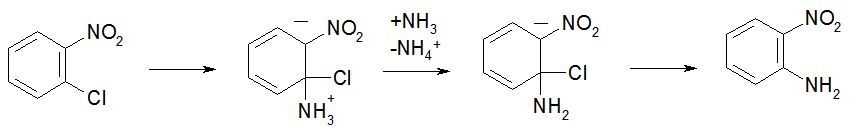
Bonjour à tous , j'ai du mal à visualiser la substitution nucléophile d'un ammoniac sur un chloronitrobenzène.
Mon problème est que je pense comme ceci :
le groupement nitro attire les électrons. Les électrons pi se délocalisent à chaque fois. Il n'y a donc pas le temps d'y avoir une apparition d'un incrément positif assez marqué pour que la substitution nucléophile puisse avoir lieu. Alors qu'elle a lieu cette attaque ?
En plus le prof avait dit en cours que sur un noyau benzène , on ne faisait que ( peut être n'a pas t il dit le que ) des substitutions électrophiles , or ici on parle de substitution NUCLEOPHILE !?!?
-----