Bonsoir ;
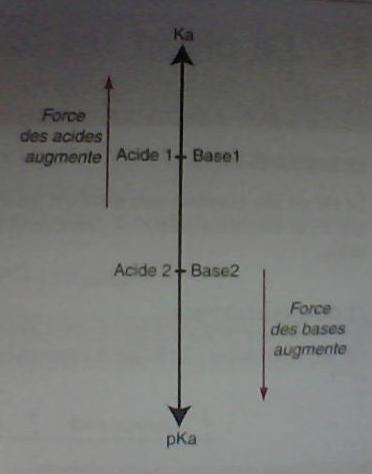
j'ai Fais le tour sur le net en ce qui concerne la forces des acide et les base et j'ai pas trouvé ce que je cherchais ; Ma question est la suivante :
comment peut-on distingué dans notre problème si on a faire a un acide fort ou faible ( base forte ou faible) ...
je sais quand que c'est fort ça veut dire qu'il s'est dissocié complètement dans l'eau ; ça je le sais
Mais par rapport au valeur de Ka et de Pka et de Ph aussi !
si par exemple on nous demande cherché le Ph ( et on a le ka ou Pka ); je ne sais pas quelle loi je dois choisir pour calculé le ph
( Vu que je ne sais pas si c'est un acide fort ou faible )
pour couronné le tous ; es que à partir des valeur de Ka et Pka on peut distingué s'il est fort ou faible ??? es qu'il existe une intervalle de valeur de Ka et Pka à suivre
et merci !!
-----