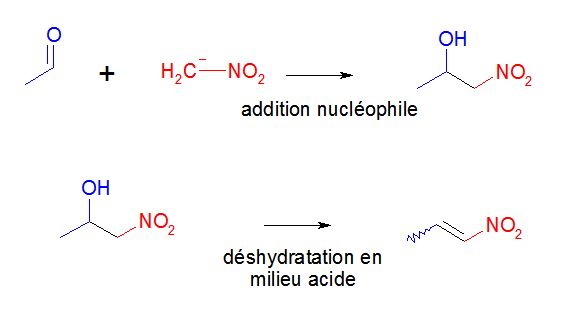
Bonjour à tous,
je vous pose tt d'abord l'exercice qui me gène :
Le nitrométhane, en présence d’un catalyseur basique, donne une réaction d’addition
sur l’éthanal. Le produit obtenu fait ensuite l’objet d’une réaction de déshydratation favorisée
en milieu acide. Dans ce cas, parmi les 3 isomères possibles, un seul produit est formé.
A. La réaction du nitrométhane avec l’éthanal est une addition électrophile.
B. Le produit de la 1ère réaction est le 1-nitropropan-2-ol.
C. Le produit de la 1ère réaction est un racémique.
D. Le produit de la 2ème réaction est le 3-nitropropène.
E. Le produit de la 2ème réaction est le (Z)-1-nitropropène.
J'ai beaucoup de mal à comprendre cet exercice dont les réponses sont B et C; je pense qu'il s'agit d'un mécanisme d'addition nucléophile (qA) mais je n'arrive pas à représenter les réactions.
Merci à qui voudra bien m'aider.
(J'espère que le peu de réponse que j'apporte n'agacera pas de modérateur ...)
-----