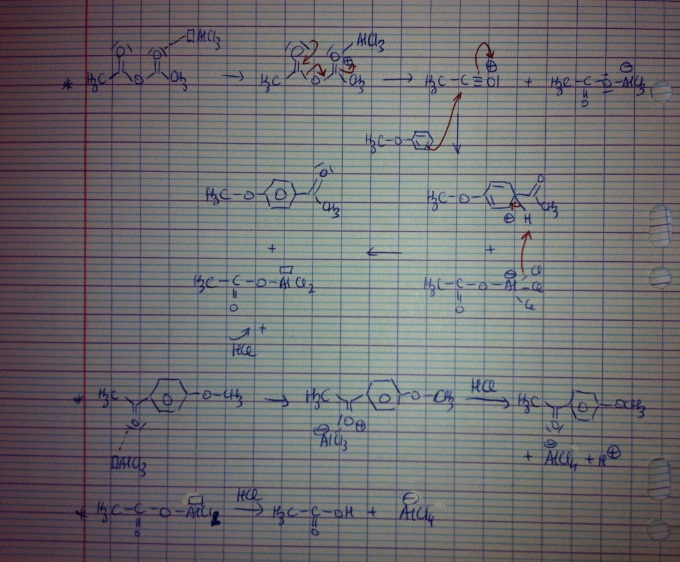
Bonjour,
dans le cadre de la synthèse 4-methoxyacetophenone en faisant réagir 0,1mol d'anisole avec 0,1mol l'anhydride acétique en présence de 0,21mol d'AlCl3 dans le toluène, on nous demande quels sont les produits d'acylation que l'on peut obtenir théoriquement?
D'après moi, au delà du para-methoxyacetophenone, qu'il se formait l'ortho-methoxyacetophenone, le para-ortho-méthoxydiacetophenone, le para-méthylacetophenone, l'ortho-méthylacetophenone et le para-ortho-méthyldiacetophenone, ai-je bon?
Par ailleurs, on nous demande pourquoi on ne forme presque exclusivement que le para-methoxyacetophenone?
J'ai émis les hypothèses que c'est dû au fait que :
- on ne forme que le produit 4-methoxyacetophenone, et pas le 2-methoxyacetophenone pour une raison d'encombrement stérique
- on ne forme pas les produits issus du toluène car l'anisole est plus réactive que le toluène dû à l'effet mésomère du groupement methoxy
- et qu'on utilise que 2 équivalents d'AlCl3 pour 1 équivalent d'anhydride acétique, pour les 2 groupements carboxyles sur la molécule, et donc on ne peut pas aller jusqu'à la double acylation
Je ne suis peut-être pas très clair mais si c'est le cas n'hésiter pas à me demander des précisions, et je souhaiterai savoir si vous pouviez me dire si mes réponses sont correctes s'il vous plaît?
Je vous remercie d'avance!
-----