Bonjour besoin d'un coup de pouce pour mon dm de chimie. Merci.
A. Un médicament, contenant des ions fer (II) Fe²⁺, se présente sous forme de comprimés. On cherche à vérifier la teneur en ion fer (II) en effectuant un dosage spectrophotométrique. En présence d'une solution incolore d'o-phénanthroline, les ions Fe²⁺ (aq) réagissent avec apparition d'une coloration rouge. La conception effective des ions Fe²⁺ (aq) de cette solution peut alors être déterminée par la mesure de l'absorbance de la solution pour une longueur d'onde de 500 nm.
1. Pourquoi choisir une longueur d'onde λ = 500 nm pour ces mesures d’absorbance au spectrophotométrique*?
2. Pourquoi la solution d'o-phénanthroline doit-elle être introduite en excès par rapport aux ions fer (II)*?
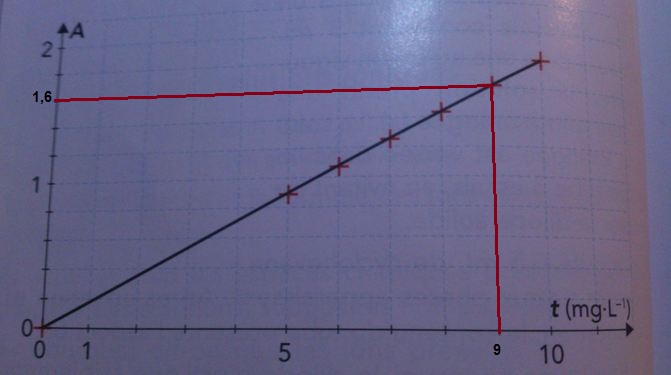
A partir d'une solution S de concentration massique t = 20,0*10-³ g.L-¹ en ions fer (II) et en présence d'o-phénanthroline, on réalise un échelle de teinte. Le graphe donnant l'évolution de l'absorbance A en fonction de la concentration massique t en ions Fe²⁺ (aq) est donné ci-dessous*:
http://image.noelshack.com/fichiers/...1-dsc-0052.jpg
3. En exploitant ce graphe, établir la relation numérique entre les grandeurs A et t, en précisant les unités.
B. On écrase un comprimé du médicament dans un mortier. La totalité du comprimé écrasé est introduite dans une fiole jaugée de 1 000 mL. On complète avec de l'eau distillée et on agite longuement la solution. La solution S₀ obtenue est incolore. Dans une fiole de 50,0 mL, on verse 5,0 mL de S₀ puis on ajoute de d'o-phénanthroline dans les mêmes proportions que celles utilisées pour préparer l'échelle de teinte. La fiole est complétée avec de l'eau distillée*: soit S'₀ la solution obtenue. L'absorbance de la solution S'₀, pour λ = 500 nm, est égale à A' = 1,45.
4. Déterminer la concentration massique t'₀ en ion Fe²⁺ (aq) dans la solution S'₀. En déduire la concentration massique t₀ en ion en ion Fe²⁺ (aq) dans la solution S₀.
5. Calculer la masse d'ions Fe²⁺ (aq) contenue dans un comprimé.
6. D'après la notice, la masse de «*sulfate ferreux sesquihydraté*» dans un comprimé est de 256,30 mg alors que la masse d'ions Fe²⁺ est de 80 mg. En notant FeSO₄, nH₂O la formule du sulfate ferreux sesquihydraté, montrer que n = 1,5.
______________________________ ______________________________ ____________________
A
1. Parce que la coloration est visible à partir de 500 nm.
2. Parce qu'il y a beaucoup d'ions
3. A est proportionnel à t (vérification de la loi de Beer-Lambert)
B
4. C(t'₀) = V₀*t/V
-----





 ) ?
) ?