Bonsoir,
Je suis actuellement en train de plancher sur un exercice de chimie orga et je bloque sur une question en rapport avec les énergies de liaison.
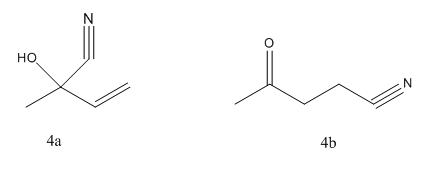
A température ambiante j'obtiens majoritairement un composé A issu d'une AN 1,2 comportant une liaison O-H, C=C et C≡N.
A température élevée (350K) j'obtiens exclusivement un composé B issu d'une AN 1,4 comportant une liaison C=O et une liaison C≡N.
Je dois justifier l'obtention exclusive de B à température élevée à l'aide des énergies de liaison fournies...
Je n'ai aucune idée de comment faire ça.
Je constate seulement que les énergies de liaison de la liaison C=O et de la liaison C≡N sont plus fortes que les énergies de liaison de la liaison O-H et de la liaison C=C.
Je ne vois pas le rapport entre les énergies de liaison, le chauffage et la favorisation d'une AN 1,2 ou 1,4.
NB : La composé B a été obtenu après une tautomérie énol-cétone, ce qui a naturellement favorisé l'obtention de la cétone. Est-ce là la clef du problème : justifier le fait que l'énol est bien plus instable que la cétone et sa forte énergie de liaison ?
Merci d'avance et bonne soirée!
-----