Bonjour,
Je suis sur un exercice depuis plusieurs jours sans trop de succès.
Voilà l'énoncé:
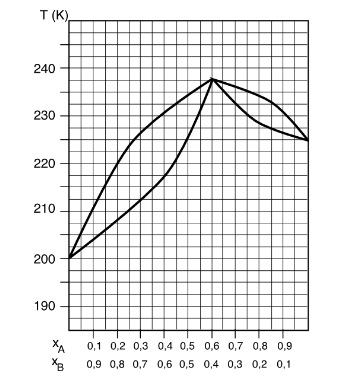
Soit le diagramme des phases d'un mélange azéotropique de deux liquides, A et B, sous une pression de 1,3 atm:
On a mélangé 166,7 g de A(l) (M=100 g/mol) et 33,30 g de B(l) (M=80 g/mol).
On réalise une distillation fractionnée de ce mélange.
a)S'agit-il d'un azéotrope à maximum ou à minimum ?
b)Quel composé sortira en tête de la colonne de distillation ? Décrivez ce qui se passera ensuite.
c)Quelle est la composition de l'azéotrope et que vaut sa température d'ébullition?
d)Calculez la masse du composé A pur qui a pu être séparée de l'azéotrope.
Pour les questions a) => c), j'ai tout trouvé et compris. Azéotrope à maximum (la température de l'azéotrope est plus élevée que celle des corps purs); on recueillera d'abord le composé A et ensuite l'azéotrope. La composition de l'azéotrope est de xA=0,6 et sa température d'ébullition de 237,5K.
Je n'arrive pas à trouver le d) par contre. J'ai un peu de mal à saisir ce qui se passe concrètement, donc du mal à faire un calcul qui a du sens ^^
Merci de votre aide.
-----