Bonjour,
J'ai quelques soucis avec la compréhension d'un passage d'un livre concernant la théorie des orbitales moléculaires.
L'exemple du passage est le complexe [CoF6]3-, qui a 18 électrons.
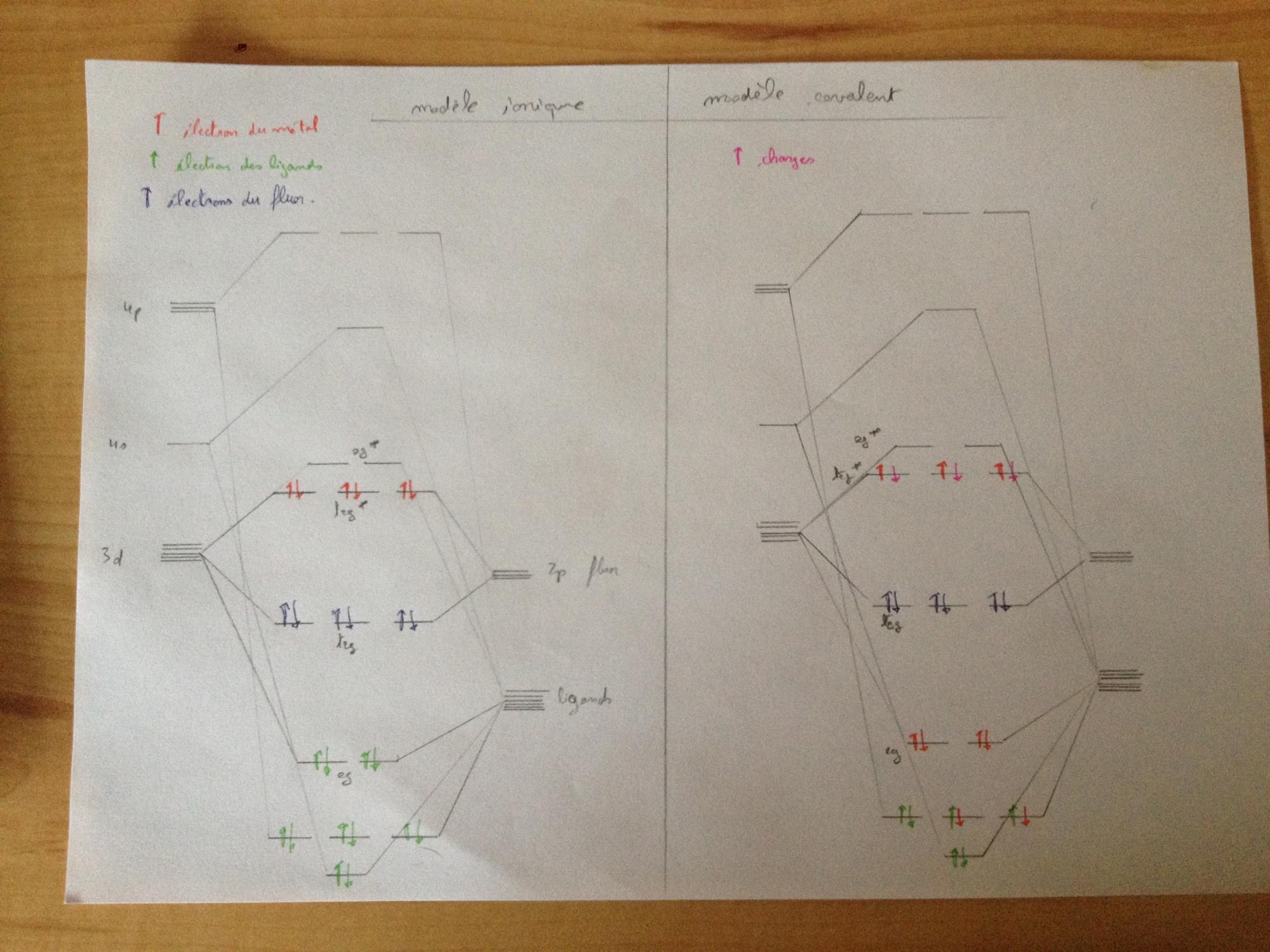
Je cherche à établir le diagramme d'orbitales moléculaires pour les liaisons σ et π pour ce complexe.
Le diagramme des liaisons σ pour un complexe Oh est celui-ci :
IMG_0079.jpg
Pour prendre en compte les liaisons π il faut modifier le diagramme ci-dessus en ajoutant l'interaction avec les orbitales 2p des ligands F :
IMG_0078.jpg
Le texte (voir PJ) explique que comme les orbitales 2p des F sont pleines, les électrons qui les occupent peuplent les 3 OM du niveau t2g et que les orbitales du métal peuplent les autres orbitales jusqu'à occuper le niveau t2g*. Il est aussi dit que le gain global d'énergie est faible et dû à la différence de peuplement entre ces 2 niveaux.
Mon problème : Combien d'électrons des ligands peuplent le niveau t2g et combien d'électrons du métal peuplent le niveau t2g* ?
Ma compréhension (dites moi si je fais une erreur quelque part) : Il y a 3 orbitales du métal disponibles pour faire des liaisons π donc il faut les combiner avec 3 orbitales 2p des ligands F. Je dirais donc que 3 paires d'électrons 2p de 3 ligands F fournissent chacune 2 électrons (donc 6 au total) et peuplent COMPLETEMENT le niveau t2g. Cela implique que le restant des électrons peuplent TOUTES les orbitales plus basses en énergie ET tout le niveau t2g* (18 électrons à placer). Mais du coup, il n'y a plus de gain énergétique vue que la π et la π* sont remplies ...
Je dois sûrement mal saisir comment les électrons 2p des F remplissent les orbitales ...
Si quelqu'un peut m'aider à y voir plus clair je l'en remercie grandement.
-----