Bonjour ! Merci de passer par là, tout d'abord :
J'ai fais l'analyse HPLC d'un liquide que je savais contenant des carbones et hydrogènes.
Toutefois, j'ai peur d'avoir mal compris le principe de cette méthode d'analyse :
Voici ce que j'en ai compris :
- On rentre l’échantillon
- L'éluant l’entraîne plus ou moins, suivant la polarité des molécules : un éluant polaire entraînera mieux les molécules polaires, qui sortiront donc plus vite.
- On compare les temps de sortie avec ceux des solutions tabulées.
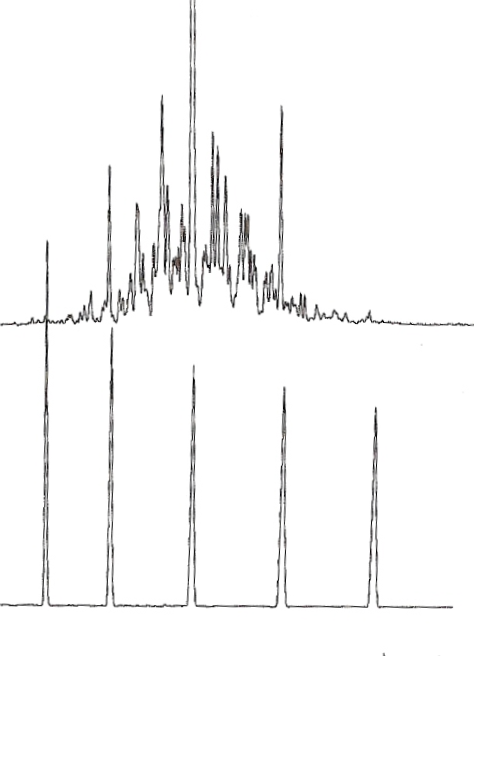
J'obtient ceci, en comparant avec "C8 C9 C10 C11 C12" (En haut mon composé, en bas les carbones tabulés)
### lien supprimé
J'aimerais en conclure que mon composé contient des hydrocarbures avec entre 8 et 11 carbones (Si j'ai bien compris)
Toutefois, je ne comprend pas 2-3 aspects :
- Les chaines carbonées sont très peu polaires, comment comparer deux chaines avec 1 ou deux carbones de plus ou moins ? Quel est l'ordre de grandeur de la différence de polarité si tel est le cas ?
- A quoi sert la phase stationnaire ? Elle semble retenir plus ou moins les composés, peut etre pour "garder" les composés apolaires ?
Merci d'avance !
-----