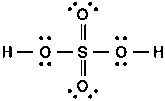
Bonjour,
On me demandant de representant H2SO4 j'ai procedé comme suite [apres reorganisation de la configuration absolue)
Mais sur ma correction je trouve qu'il y a deux liaisons datives avec les deux oxygenes
Je me demandais si ma prepresentation etait fausse, et comment je peux deviner s'il y a une liaison dative ou pas, comme dans ce cas ?
merci
-----