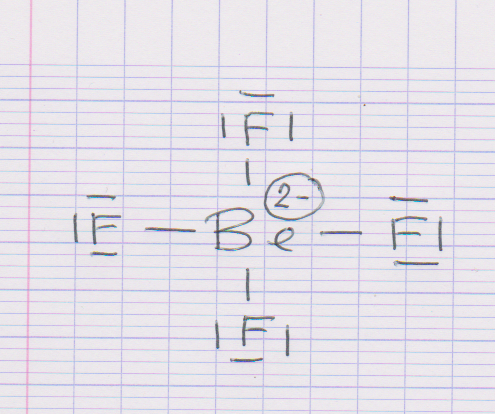Bonjour,
Je suis sur un exercice qui consiste à trouver la géométrie d'une molécule à partir de la méthode VSEPR.
La molécule estavec Be l'atome central.
J'ai déterminé la formule de Lewis.
J'obtiens donc la formule de Lewis suivante :
Je trouve donc par méthode VSEPR que la structure est de type carréen tenant compte des deux charges moins sur le Be.
Or dans la correction de l'exercice j'ai.
Ma question est de savoir si la charge formelle correspond à deux électrons ou pas.
Merci pour vos réponses.
-----