Bonsoir à tous
Je bloque sur un exercice de cinétique dont l'énoncé est le suivant :
On étudie la vitesse de réaction de Fe3+ + I- = Fe 2+ + 1/2 I2
Pour cela on mesure x = [Fe2+] au cours du temps et à 25°C.
Bonsoir à tous
Je bloque sur un exercice de cinétique dont l'énoncé est le suivant :
On étudie la vitesse de réaction de Fe3+ + I- = Fe 2+ + 1/2 I2
Pour cela on mesure x = [Fe2+] au cours du temps et à 25°C.
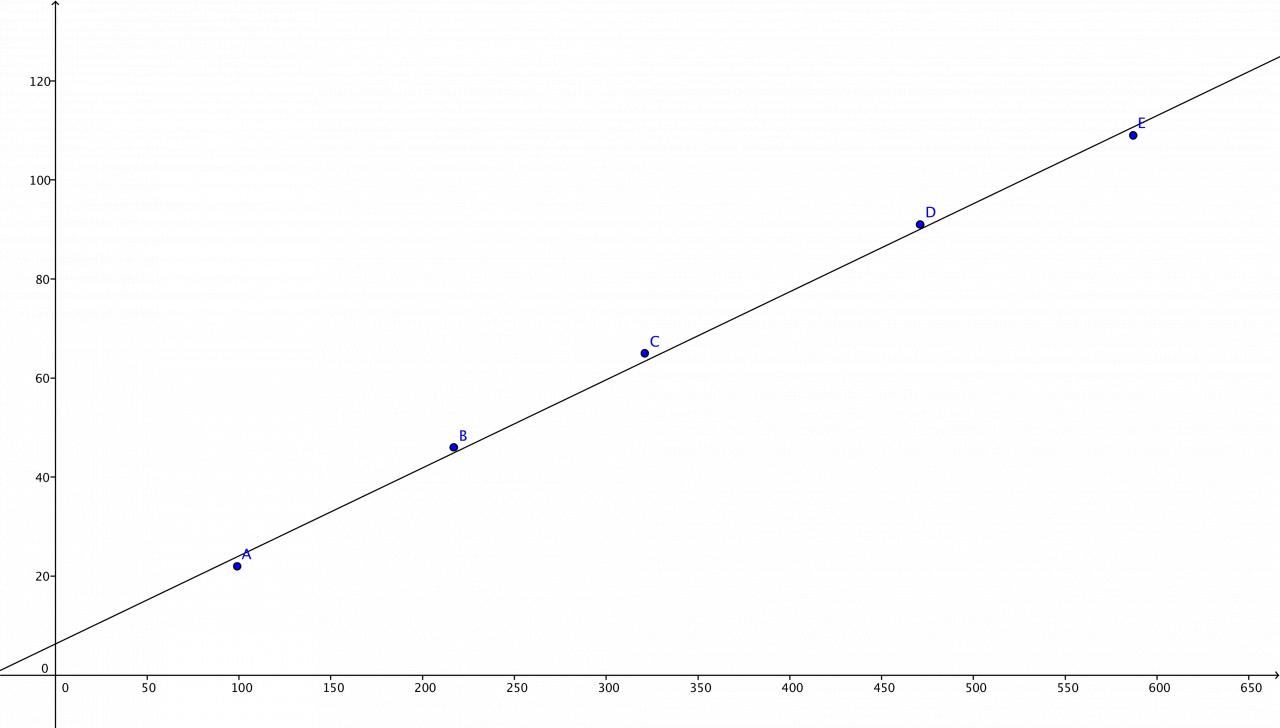
t(s) | 99 | 217 | 321 | 471 | 587 |
10^5 x (mol/L) | 22 | 46 | 65 | 91 | 109 |
Déterminer la vitesse v0 de la réaction
Pour cela j'ai effectué une régression linéaire x = f(t)
Je trouve une droite d'équation y = at + b avec à= 17782,2
b= 631833,97
Après j'ai dérivé pour avoir la tangente à l'origine ce qui me donne v0 = 17782.2 .
Cependant il s'agit d'un exercice corrigé qui me donne comme réponse v0 = 2,33 .10^-6 mol/L/s
Je dois donc me tromper dans mon raisonnement mais je ne sais pas où..
Merci de votre aide
-----





 .
.